Разновидности коррозии
Перед тем как защитить металл от ржавчины, следует узнать о существующих видах. Способ обеспечения антикоррозийной защиты находится в прямой зависимости от условий применения деталей. Потому принято выделять следующие типы:
- коррозия, которая связана с явлениями атмосферного характера;
- разрушение структуры металла в воде из-за наличия в ней солей и бактерий;
- деструктивные процессы, происходящие в грунте (почвенная коррозия).
Способы антикоррозионной защиты при этом должны подбираться в индивидуальном порядке, руководствуясь тем, в каких условиях будет эксплуатироваться изделие из металла.
Что касается типов поражения конструкций, то они могут быть следующими:
- ржавчина находится на всей поверхности изделия отдельными участками или сплошным покрытием;
- имеет вид пятен и проникает вглубь элемента;
- разрушает молекулы металла, приводя к трещинам;
- масштабное ржавление, при котором разрушается не только поверхность, но и более глубокие слои.
Типы разрушения бывают и комбинированными. В некоторых ситуациях их очень сложно определить на глаз, особенно при точечном ржавлении.
Принято выделять химическую коррозию. При контакте с нефтяными продуктами, спиртами и иными агрессивными веществам происходит особая реакция, которая сопровождается высокой температурой и выделениями газа.
При электрохимической коррозии поверхность металлического сплава соприкасается с водой (электролитом). При этом осуществляется диффузия материала. Электролит обуславливает появление электротока, а электроны металла замещаются и приходят в движение, в результате чего возникает ржавчина.
Обеспечение защиты от коррозии и выплавка стальных изделий — две взаимосвязанные вещи. Коррозия причиняет существенный ущерб постройкам хозяйственного или промышленного назначения. Кроме того, этот процесс может привести к катастрофе, если говорить, например, об опорах электропередач, мостах, заграждениях и т. д.
Может ли вода защитить металл от коррозии?
Все привыкли думать, что вода не то, что может защитить металл от коррозии, она ее и провоцирует! Однако, в 21 веке это уже не так.
Вполне ясно, что металлическое изделие не поливают простой проточной водой, чтобы она защитила конструкцию – все немного сложнее.
Вода является основой для защитного покрытия металла от коррозии. Сегодня не редко можно встретить выражение «краска на водной основе» – это оно и есть. Покрытия на водной основе только начинают завоевывать рынок антикоррозионных средств, однако уже зарекомендовали себя. Они не уступают по качеству другим известным покрытиям на других основах, является долговечными, а их цена приятно радует потребителей.
Кроме красок на водной основе, существуют и разрабатываются такие вещества как водные отвердители и смолы.
Защита металла в бытовых условиях
Коррозия, способы защиты от нее в бытовых условиях требуют соблюдения определенной последовательности:
1. Перед нанесением грунтовки или преобразователя ржавчины поверхность тщательно очищают от загрязнений, масляных пятен, ржавчины. Используют металлические щетки или специальные насадки для болгарки.

2. Затем наносят грунтующий слой, дают возможность впитаться и просохнуть.

3. Далее изделие красят в два слоя. Предварительно дают высохнуть первому. При работе необходимо использовать защитные средства (перчатки, очки, респиратор).

Защита металлов от коррозии сложный процесс. Начинается он еще на этапе выплавки стали. Перечислить все методы борьбы с ржавчиной трудно, так как они постоянно совершенствуются, не только в промышленности, но и для бытового использования. Производители лакокрасочных изделий постоянно совершенствуют составы, повышая их коррозийные свойства. Все это значительно продлевает сроки эксплуатации металлоконструкций и стальных изделий.
Методы противостояния коррозионным процессам
Основные методы, применяемые для противодействия коррозии, приведены ниже:
- повышение способности материалов противостоять окислению за счет изменения его химического состава;
- изоляция защищаемой поверхности от контакта с активными средами;
- снижение активности окружающей изделие среды;
- электрохимические.
Первые две группы способов применяются во время изготовления конструкции, а вторые – во время эксплуатации.
Методы повышения сопротивляемости
В состав сплава добавляют элементы, повышающие его коррозионную устойчивость. Такие стали называют нержавеющими. Они не требуют дополнительных покрытий и отличаются эстетичным внешним видом. В качестве добавок применяют никель, хром, медь, марганец, кобальт в определенных пропорциях.

Нержавеющая сталь AISI 304
Стойкость материалов к ржавлению повышают также, удаляя их состава ускоряющие коррозию компоненты, как, например, кислород и серу — из стальных сплавов, а железо – из магниевых и алюминиевых.
Снижение агрессивности внешней среды и электрохимическая защита
С целью подавления процессов окисления во внешнюю среду добавляют особые составы — ингибиторы. Они замедляют химические реакции в десятки и сотни раз.
Электрохимические способы сводятся к изменению электрохимического потенциала материала путем пропускания электрического тока. В результате коррозионные процессы сильно замедляются или даже вовсе прекращаются.
2 метода защиты от коррозии металлов

Коррозия в переводе с латинского означает «разъедание», это легко объясняет сущность данного понятия. С научной точки зрения коррозия является процессом самопроизвольного разрушения металлов вследствие химических и физико-химических взаимодействий с окружающей средой.
Причиной для начала данного процесса служит отсутствие термодинамической устойчивости того или иного металла при воздействии веществ, которые находятся в контактирующей с ним среде.
Сегодня проблема антикоррозийной защиты различных видов конструкций, продукции и материалов достаточно актуальна для многих стран мира. Особенно страдают промышленно развитые страны, ведь коррозия металлов причиняет весомый ущерб экономике этих государств.
Поэтому данный вопрос занимает довольно большую роль не только в быту, но и в государственных масштабах, ведь его решение должно быть основано на необходимости сохранения природных ресурсов, защиты окружающей среди и, конечно же, рационального использования и хранения различного рода металлических конструкций в производстве.
Если нет времени ждать сантехника, значит необходимо принимать решение по самостоятельной чистке раковины.
Также узнайте, как бороться с засором в унитазе.
Коррозия имеет широкое распространение и разнообразие тех условий и сред, в которых она может начаться. Поэтому конкретной классификации различных случаев коррозии пока нет.
В таблице представлена обширная типизация коррозии, существующая на сегодняшний день.
| Условие/среда, способствующая протеканию процесса коррозии | Виды коррозии | |
| По типу агрессивных сред | газовая коррозия | |
| коррозия в неэлектролитах | ||
| коррозия в электролитах | ||
| атмосферная коррозия | ||
| подземная коррозия | ||
| коррозия по причине воздействия блуждающих токов | ||
| биокоррозия | ||
| По условиям протекания процесса коррозии | контактная коррозия | |
| щелевая коррозия | ||
| коррозия при полном погружении | ||
| коррозия при частичном погружении | ||
| коррозия при попеременном погружении | ||
| межкристаллическая коррозия | ||
| коррозия при трении | ||
| коррозия под напряжением | ||
| По характеру разрушения | сплошная коррозия | равномернаякоррозия |
| неравномернаякоррозия | ||
| избирательнаякоррозия | ||
| местная коррозия | язвеннаякоррозия | |
| точечнаякоррозия | ||
| коррозия пятнами | ||
| сквозная коррозия | ||
| межкристаллитнаякоррозия | ||
| По механизму протекания процесса коррозии | химическая | |
| электрохимическая |
Огромное количество видов коррозии повлекло за собой появление столь же большого количества методов и приемов борьбы с каждым из них. Но вопрос этот не закрыт и продолжаются работы по созданию новых методов, которые будут более действенными.
Выбираем правильный анод
Важным моментом в процессе формирования электрохимической защиты является выбор анода. Мы рассмотрим все наиболее удачные из распространённых вариантов, чтобы вам было проще сделать свой выбор.
Металлический гараж
Это самый простой, наиболее доступный и, соответственно, самый распространённый вариант анода. А если в этом гараже ещё и пол сделан из железа или хотя бы имеется открытая арматура, то днище машины также будет защищено от пагубного влияния коррозии. В летнее время сила защиты возрастает за счёт парникового эффекта. Для формирования защиты при таком выборе анода потребуется металлический корпус сооружения (в нашем случае это гараж) соединить с плюсом на аккумуляторе. Эта батарея должна быть установлена в машине посредством резистора или провода для монтажа. Для плюса можно использовать прикуриватель, но только в том случае, если в нём сохраняется напряжение после отключения зажигания.
Контур заземления
Такой выбор анода потребует от автовладельца аналогичных действий. Но учтите, что устройство катодной защиты по большей части будет работать на днище машины. Эту ситуацию можно исправить, проделав несложную работу. В землю, по периметру расположения машины, вбивается четыре металлических стержня и соединяются они между собой обычной металлической проволокой. Подключение контура проводится по аналогии с предыдущим случаем, когда анодом служил металлический гараж.
Металлизированный резиновый хвост с эффектом заземления
Такой способ организации защиты считается самым простым, но не менее эффективным, если разговор идёт за движущуюся машину. При повышенной влажности воздуха имеет место разность потенциалов между автомобилем и влажной дорогой. По логике влияние коррозии должно усиливаться при таких условиях, но в нашем случае за счёт наличия хвоста усиливается катодная защита. Хвост обязательно должен устанавливаться сзади автомобиля. На него должна попадать влага в виде брызг, которые вылетают из-под задних колёс.
Такое приспособление выполняет ещё и роль антистатика. Хвост должен быть правильно прикреплён к машине: в изолированном положении относительно корпуса ТС по току постоянного характера, а по переменному току он должен быть «закорочен» на корпус. Такое подключение можно организовать за счёт использования RC-цепочки, которая служит элементарным частотным фильтром.
Защитные электроды-протекторы
Как отдельную тему можно рассматривать этот вид анодов, но мы постараемся уложиться в один подзаголовок. Роль защитных протекторов выполняют элементарные пластинки, сделанные из металла. Для их установки можно выбирать самые уязвимые для коррозии места в машине. Чаще всего выбираются крылья, днище и пороги. Принцип действия схож со всеми предыдущими способами.
Технология катодной поляризации
В данном случае используется так называемый наложенный ток. Для его подачи на металлический объект используется внешний проводник (часто) или источник тока (редко). При контакте с электрически активной частицей происходит следующее — частица под действием сил электрического притяжения перемещается к защитному элементу с отрицательным зарядом, где происходит «утилизация» этих частиц.
Последствия такой «утилизации» очевидны — защитный элемент со временем сам покрывается коррозией и приходит в негодность. Поэтому данную технологию очень часто называют методом жертвенного электрода (вместо нашей детали происходит ржавление «электрода-жертвы»).
Помимо силы тока и напряжения при работе с катодной поляризацией нужно учитывать еще один важный параметр — это омическое напряжение. В техническом смысле этот параметр отражает тот факт, что по мере протекания электрического заряда со временем напряжение тока в контуре падает. Само падение происходит из-за того, что протекание катодного тока происходит по контуру с более низким зарядом. В случае правильной сборки контура этот показатель является достаточно маленьким — благодаря этому в контуре будет всегда сохраняться один и тот же ток одинаковой мощности.

Технология создания станций защиты
Еще одной технологией создания катодной защиты является подключение элемента к внешним источникам тока. В большинстве случаев для этих целей сооружаются специальные станции катодной защиты (СКЗ), которые состоят из нескольких элементов — главный источник тока, анодное заземление, различные кабели и провода, соединяющие отдельные элементы конструкции и вспомогательные пункты с механическим или компьютерным управлением, которые позволяют контролировать параметры.
Чаще всего данная технология используется для объектов, расположенных рядом с проводами электропередач — это могут быть трубопроводы, различные фабричные постройки и так далее. СКЗ могут работать во многопоточном режиме — в таком случае они будут обслуживать сразу несколько защитных систем. На трубах большое распространение получила практика, при которой на трубы ставится несколько отдельных блоков для более эффективного распределения тока. Дело все в том, что в случае протяженных трубопроводов в местах подключения труб к источникам тока формируются специальные точки с повышенным уровнем напряжения электрического поля — из-за этого может происходить повреждение труб. Применение подобных блоков позволяет распределить электричество равномерно по всему защитному контуру.
Автоматизация
Контрольные пункты могут работать как в ручном, так и в автоматическое режиме:
- В случае ручного управления изменение параметров напряжения регулируется оператором. На физическом уровне регуляция осуществляется путем переключения работы трансформатора. Регулируется работа обмотки, что позволяет менять параметры электрического тока.
- В случае автоматического управления изменение параметров напряжения регулируется самим устройством на основе параметров, которые когда-то задал оператор. На физическом уровне управление осуществляется с помощью специальных полупроводников-тиристоров. Они включаются или выключаются при отклонении параметров электрического тока от заданных параметров.

Виды коррозии
Срок службы металлических конструкций учитывают при проектировании производственных мощностей, мостов, зданий. В некоторых химических производствах отдельные аппараты и их детали работают только несколько месяцев или недель.
В зависимости от причины разрушения выделяют 3 вида коррозии: атмосферная, почвенная, жидкостная. Рассмотрим их особенности.
- Атмосферная — проявляется под воздействием активных химических веществ в воздухе.
- Почвенная — происходит при взаимодействии металла с агрессивным составом грунтовых вод, почвы.
- Жидкостная — возникает при контакте с водной средой с высоким содержанием солей, которые ускоряют окисление.
Методы и способы защиты металлов от коррозии
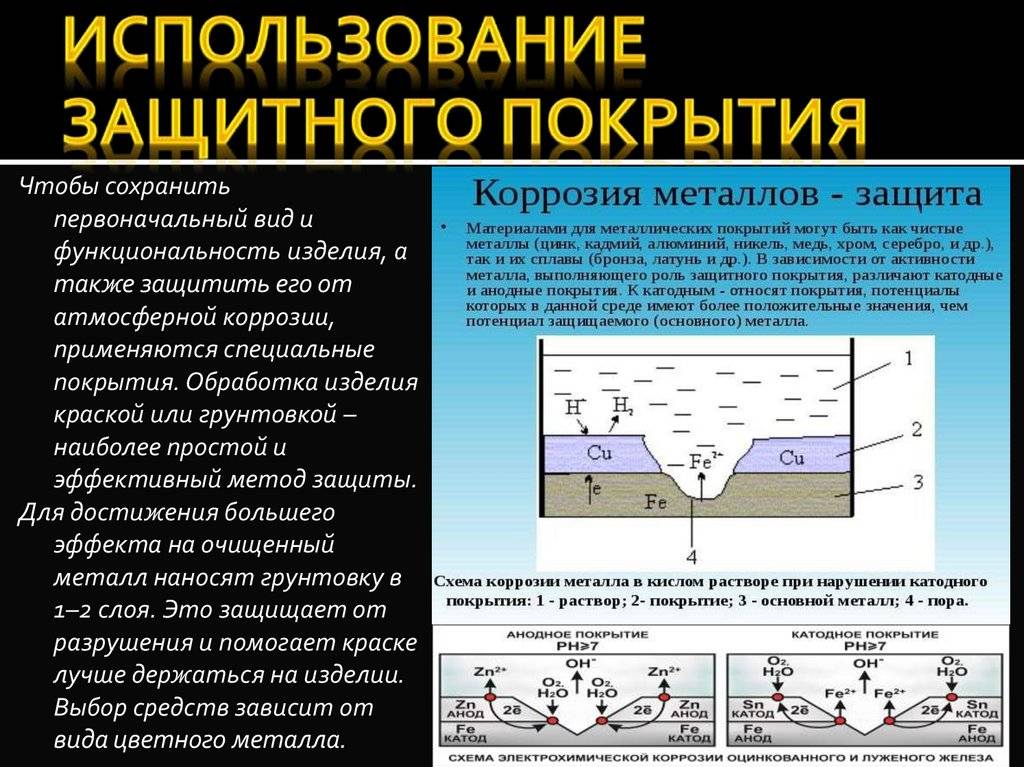
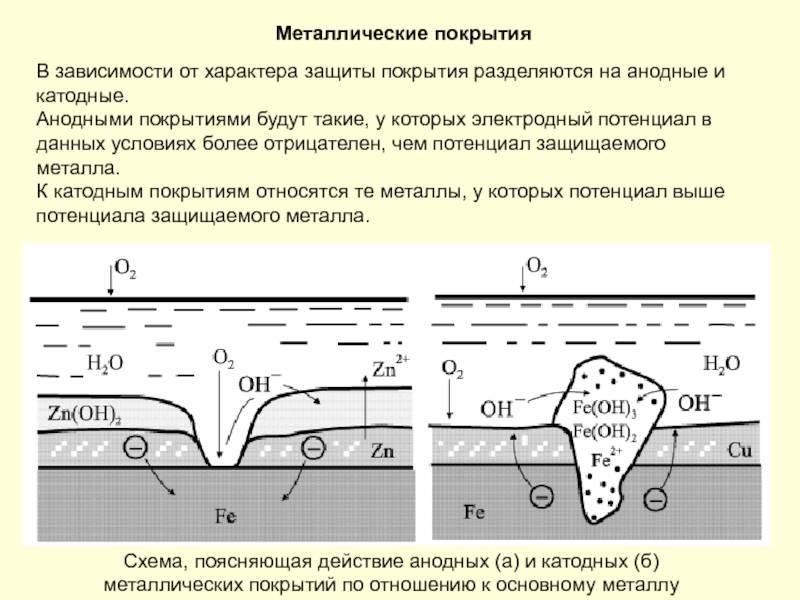
Вследствие того, что коррозийный процесс протекает на верхних слоях металла конструкции, то защита поверхности заключается в создании верхнего защитного слоя для изделия, который убирает следы коррозии на металле. Такими защитными покрытиями выступают вещества металлические и неметаллические.
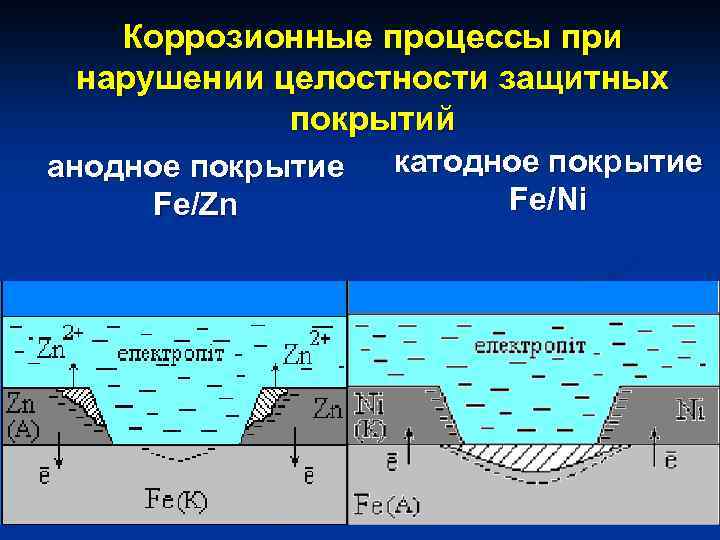
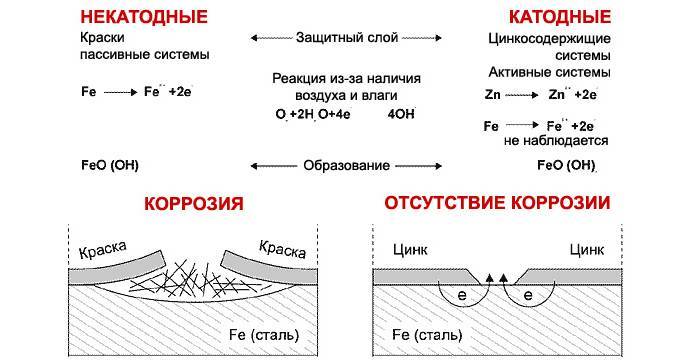
Исходя из названия, металлические покрытия – это вещества, в основе которых металл. Например, чтобы защитить конструкцию из железа от коррозии на ее поверхность наносят слои цинка, меди или никеля.

Очистка труб от коррозии
Неметаллические покрытия – специальные вещества, наиболее широкая группа защитных соединений. Они изготавливаются в виде красок, эмалей, смазок, грунтовок, составов на битумной и битумно-полимерной основе и т.д.
Большая популярность неметаллических соединений в устранении следов коррозии заключается в их широком выборе, большом ценовом диапазоне, легкости изготовления и хороших защитных свойствах.
Наименьшую популярность приобрели химические покрытия из-за необходимости проводить сложные химические процессы:
- Оксидирование – образование оксидных пленок на поверхностях защищаемых деталей.
- Азотирование – насыщение верхних слоев материала азотом.
- Цементация – реакция, при которой верхние слои соединяются с углеродом и т.д.
Также при коррозии металлов существуют способы защиты, при которых на этапе сплавления металлов в них вводят специальные соединения, которые смогут повысить коррозийную устойчивость будущего материала.
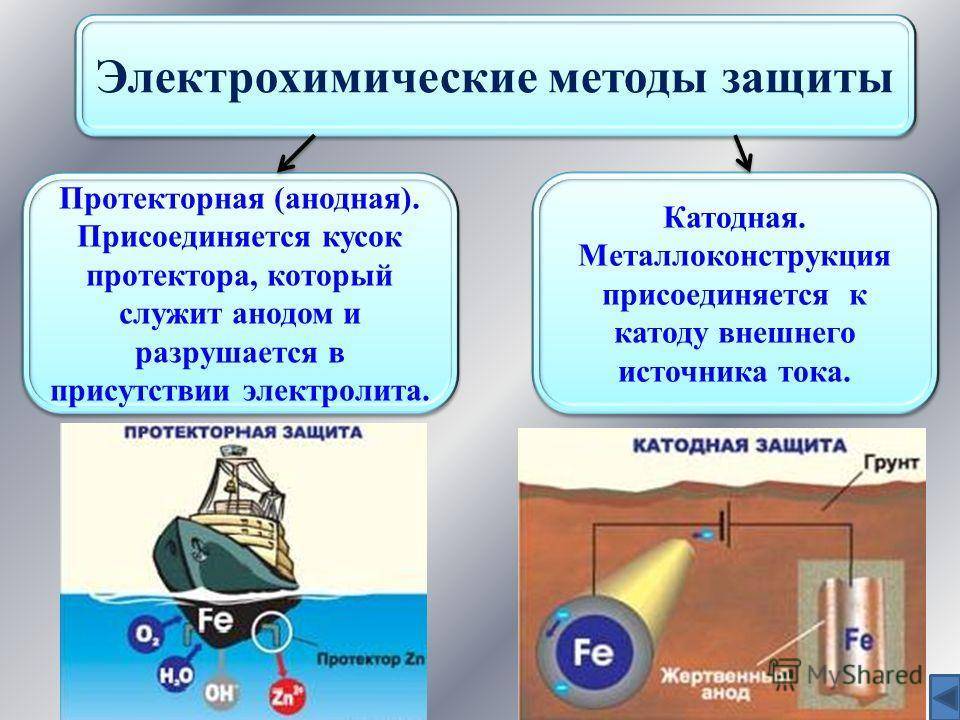
Большую группу защиты представляют способы электрохимической и протекторной защиты.
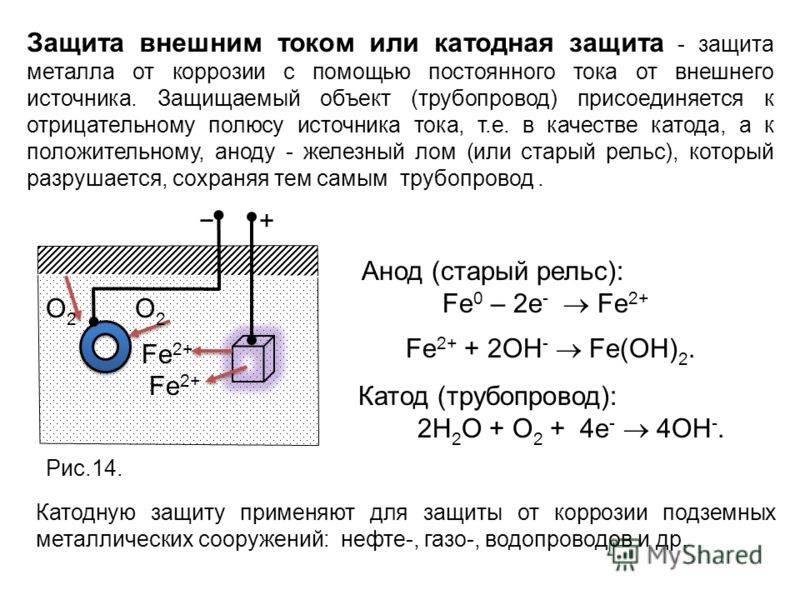
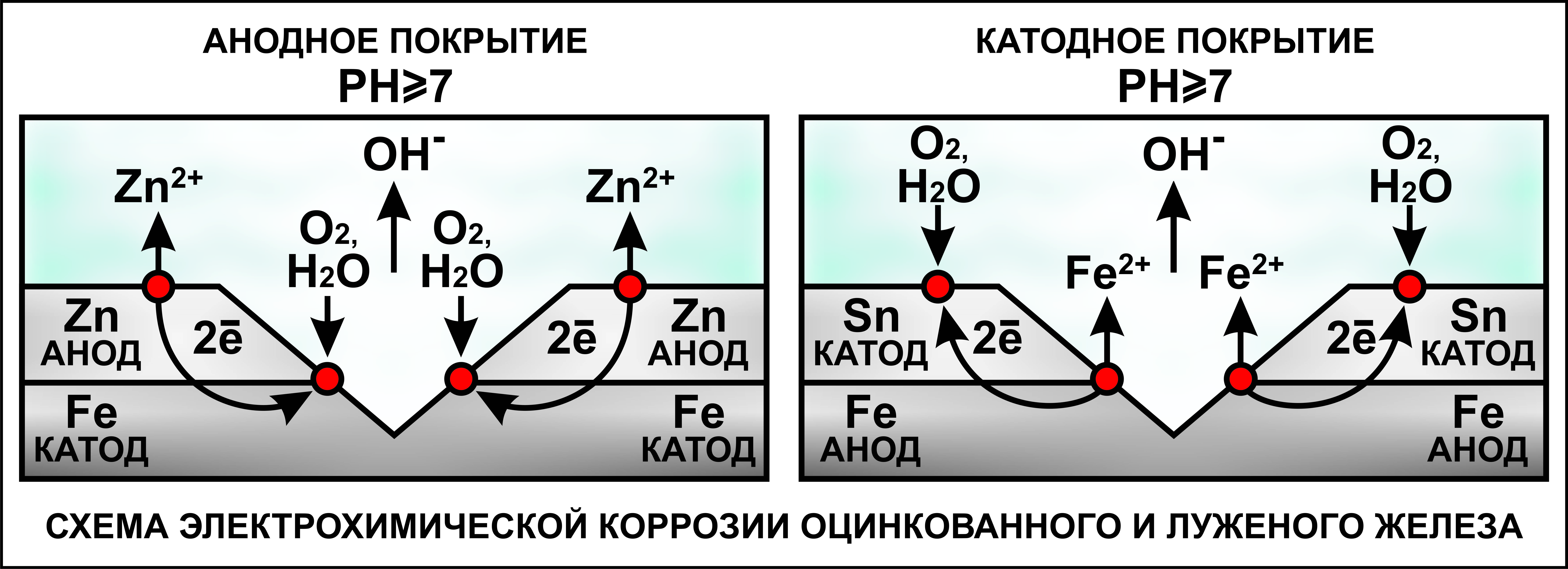
Электрохимическая защита состоит в процессе преобразования продуктов коррозии в среде электролитов с помощью проводящего электрического тока. Постоянный ток присоединяется к катоду (защищаемому материалу), а в качестве анода выступает проводящий металлический источник, который при своем разрушении защищает объект от ржавчины.

Электрохимическая защита от коррозии
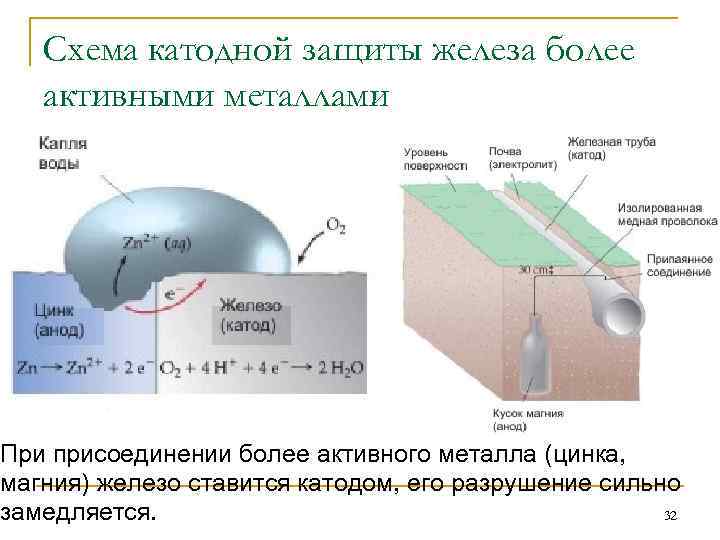
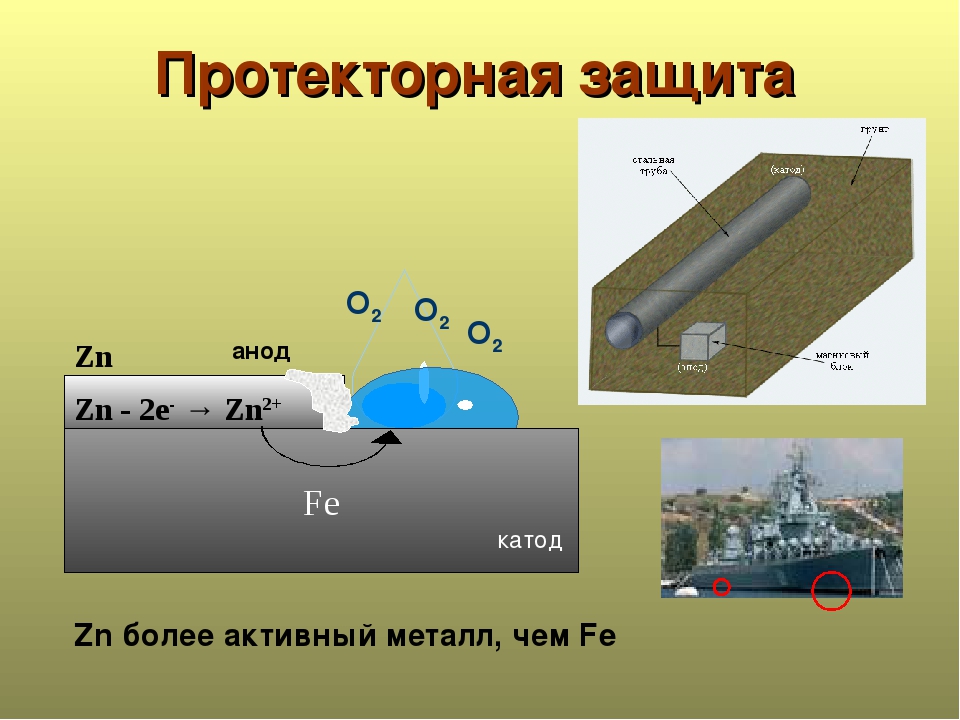
Протекторная защита протекает по такому же принципу, однако вместе металлического связующего изделия выступают специальные изделия – протекторы, которые выступают в роли анода. В результате протекающей реакции, протектор разрушается, защищая катод (конструкцию из металла).
Таким образом, хоть коррозия является необратимым процессом, но на данный момент люди научились эффективно замедлять ее губительное воздействие.
Защита металла от коррозии в домашних условиях
Металлические объекты окружают человека повсюду, в том числе и дома: ограждения, перила, домашние трубопроводы, некоторые виды кухонной утвари, техника и т.п. Также большое число населения имеет транспортные средства, а они также производятся из металлических материалов.
В домашних условиях чаще всего находятся мелкие металлические элементы, и не представляется возможным провести достаточную обработку металла от коррозии как в промышленности: зачистку, обработку и покрытие инновационными методами. Поэтому средства для дома производятся таким образом, чтобы их можно было наносить на саму ржавчину быстро и удобно. Чаще всего такими веществами выступают краски и грунтовки с добавлением ингибиторов и других добавок.
Сегодня существует огромное количество различных красок и грунтовок, с широким диапазоном цен и дополнительных добавок для защиты от ржавчины.

Нанесение лакокрасочных веществ домашних условиях является более удобным, нежели проведение таких процедур как химическая или электрохимическая реакции.
Решение задач по химии на покрытие металлов
Задание 284. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начавшееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции.Решение: При опускании пластинки из чистого цинка в раствор разбавленной кислоты, начавшееся выделение водорода вскоре почти прекратится, потому что на пластинке из цинка образуется оксидная плёнка, которая будет препятствовать дальнейшему взаимодействию цинка с разбавленной кислотой. Оксидная плёнка образуется при взаимодействии цинка с кислородом, растворённым в воде по схеме:
Zn + 1/2 O2 = ZnO
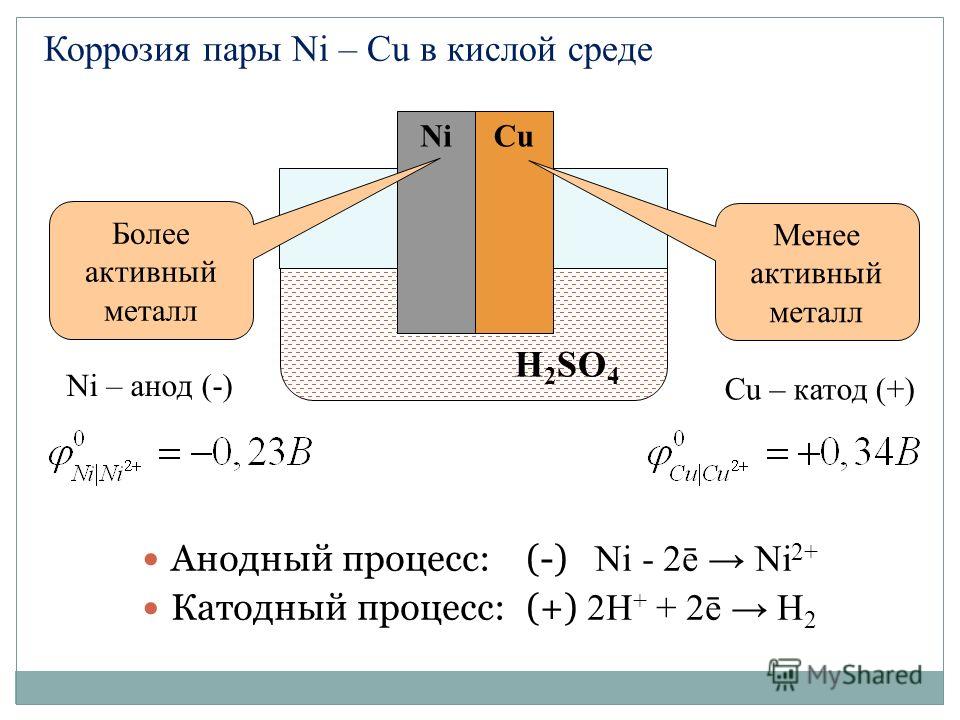
Если прикоснуться к цинковой пластинке медной палочкой, то возникнет гальваническая пара цинк — медь, в которой цинк будет являться анодом, а медь – катодом. Это происходит, потому что стандартный электродный потенциал цинка (-0,763 В) значительно отрицательнее, чем потенциал меди (+0,34 В).
Образующиеся ионы Zn2+ будут с имеющимися анионами кислоты давать соль, а ионы водорода Н+, деполяризуясь на медной палочке, Zn – 2 = Zn2+образуют водород, который в виде пузырьков газа выделяется из раствора. Ионно-молекулярное уравнение реакции будет иметь вид:
Молекулярная форма уравнения реакции:
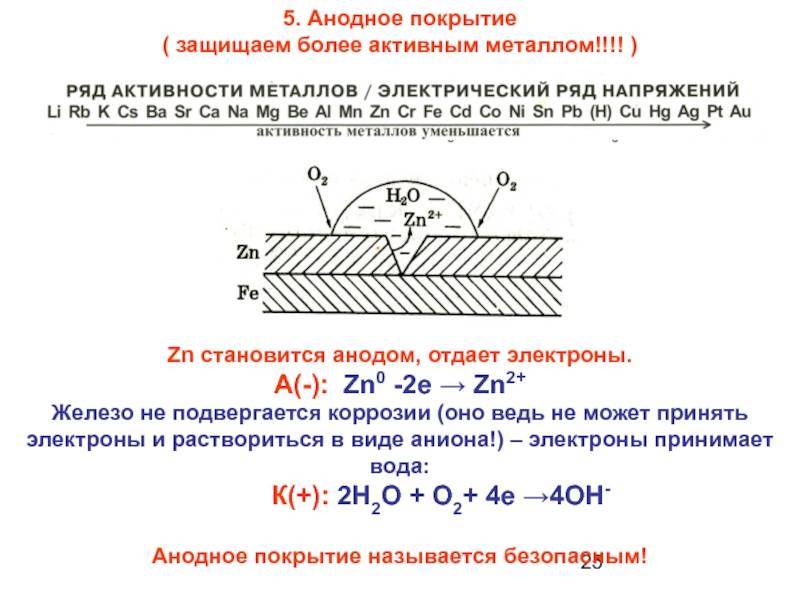
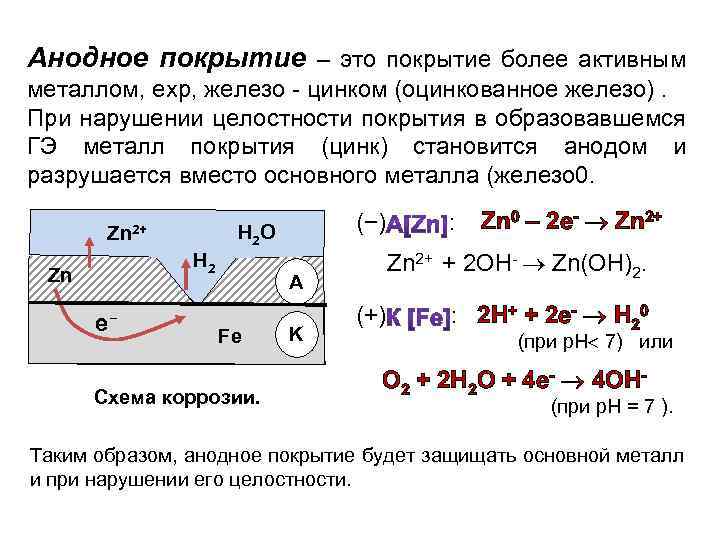
Задание 285. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.Решение: Для предотвращения коррозии стальных конструкций применяется протекторная защита: создаётся электрический контакт защищаемой конструкции с протектором – более активным металлом (обычно Zn, Mg, Al или их сплавы). При таком контакте возникает гальваническая пара типа Zn — Fe и коррозии подвергается протектор, а не сама стальная конструкция (трубопровод, корпус корабля и т.п.). Например, корпус корабля защищают протектором – цинковые брусья, которые крепят в нескольких местах днища корабля. Под действием морской воды и кислорода цинк разрушается, а корпус корабля защищается, таким образом, от коррозии. При этом протекают следующие электрохимические процессы:
Анодный процесс: Zn – 2 = Zn2+;Катодный процесс: а) в нейтральной или щелочной среде: 1/2O2 + H2O + 2 = 2OH-; б) в кислой среде: 1/2O2 + 2H+ + 2 = H2O
Таким образом, цинк разрушается, окисляясь до ионов Zn2+, которые с гидроксильными ионами образуют нерастворимый гидроксид Zn(OH)2 или в виде ионов Zn2+ уходит в раствор, если реакция среды кислая. Основной металл остаётся неповреждённым.
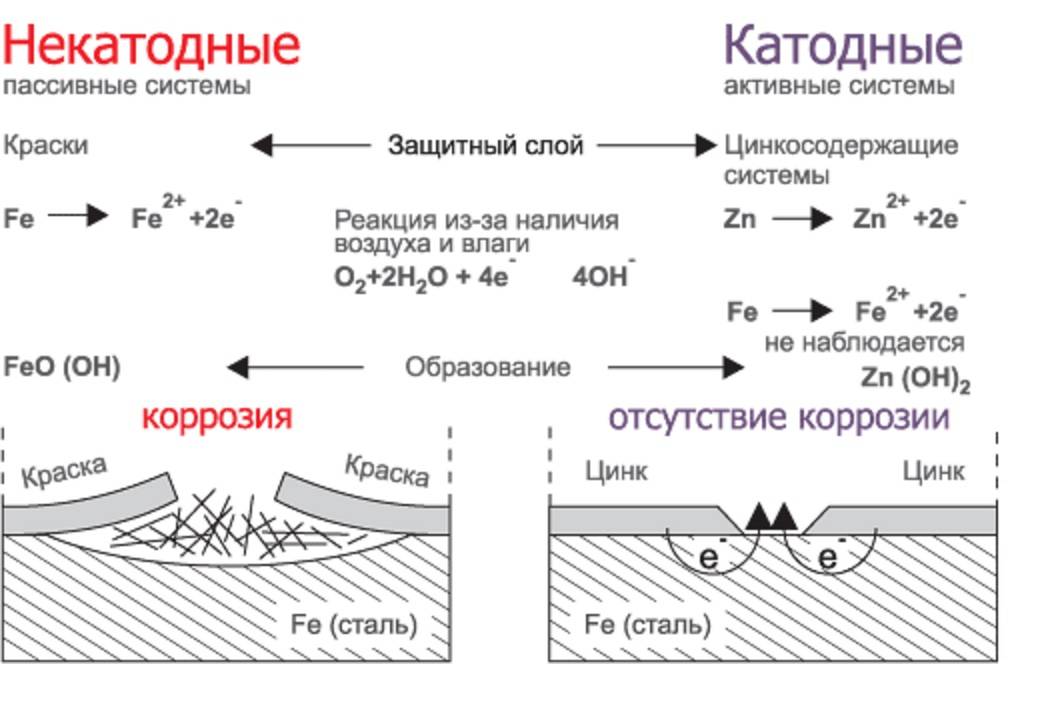
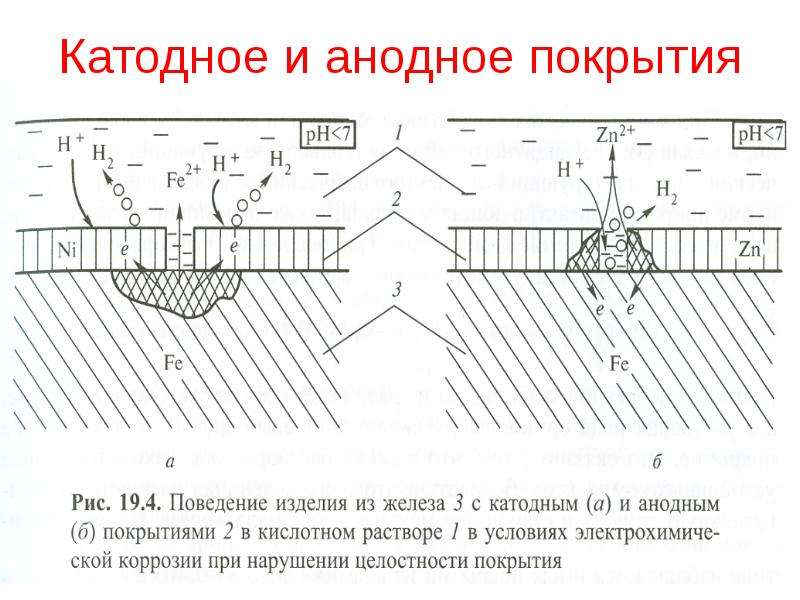
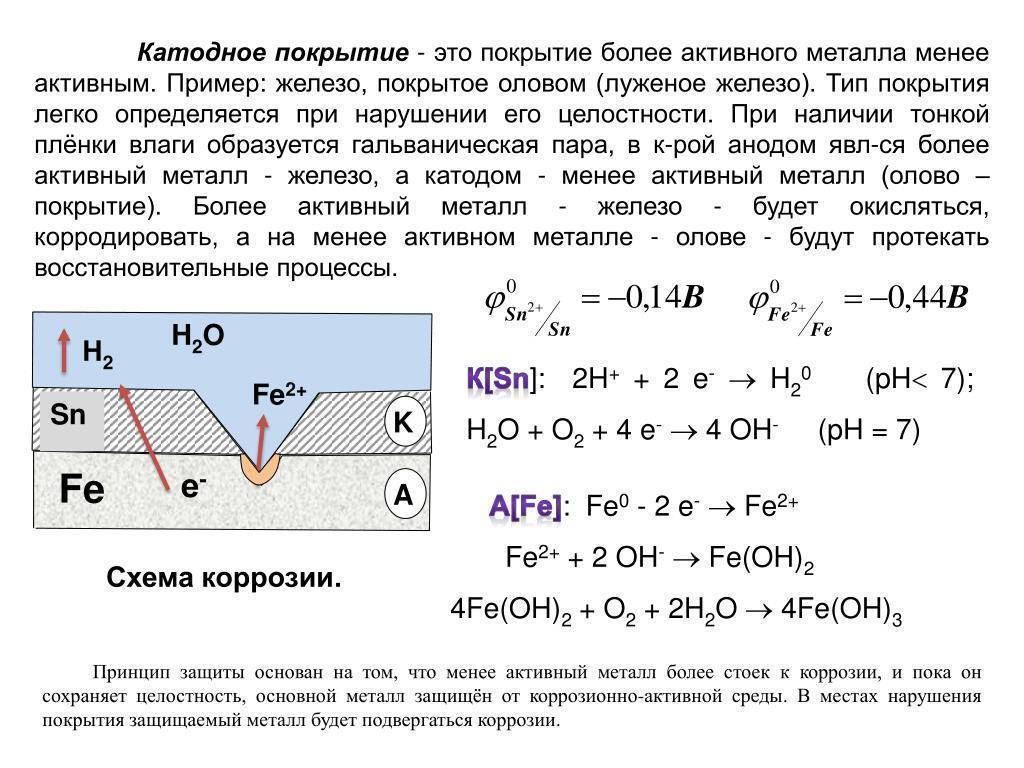
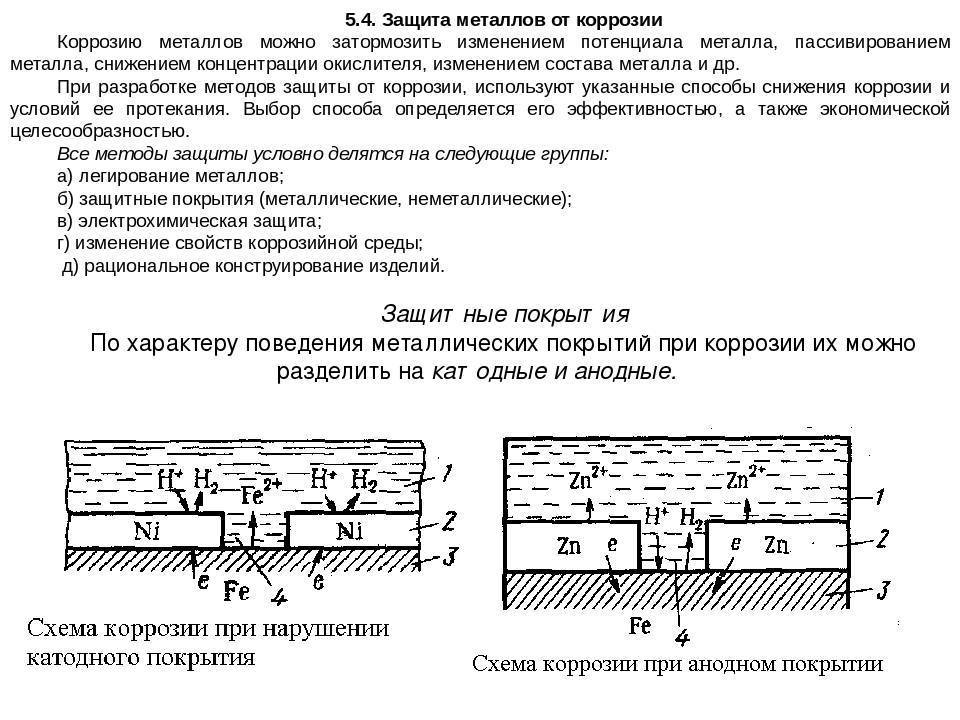
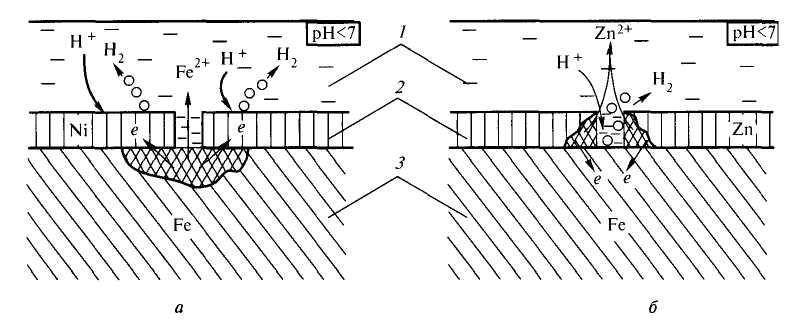
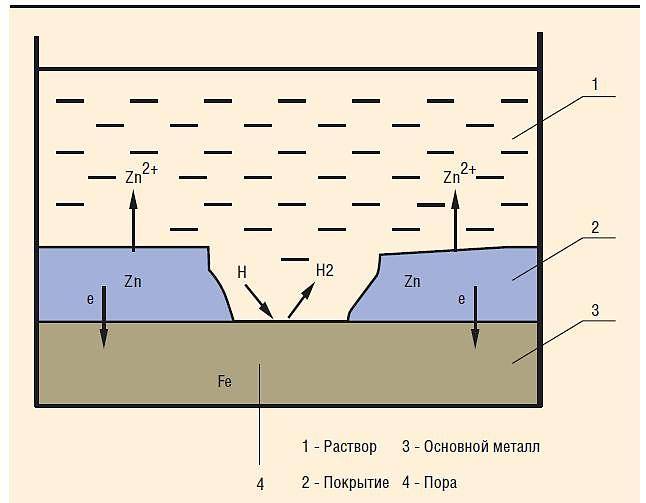
Задание 286. Железное изделие покрыли никелем. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?Решение: Железо имеет более электроотрицательный стандартный электродный потенциал (-0,44 В), чем никель (-0,24 В), поэтому железо является анодом, никель – катодом.
Анодный процесс – окисление металла: Fe – 2 = Fe2+
и катодный процесс – восстановление ионов водорода (водородная деполяризация) или молекул кислорода (кислородная деполяризация). Поэтому при коррозии пары Fe — Ni с водородной деполяризацией происходит следующие процессы:
Анодный процесс: Fe – 2 = Fe2+ Катодный процесс: в кислой среде: 2Н+ + 2 = Н2
Продуктом коррозии будет газообразный водород соединение железа с кислотным остатком (соль).
При коррозии пары Fe — Ni в атмосферных условиях на катоде происходит кислородная деполяризация, а на аноде – окисление железа:
Анодный процесс: Fe – 2 = Fe2+
Катодный процесс: в нейтральной среде: 1/2O2 + H2O + 2 = 2OH-
Так как ионы Fe2+ с гидроксид-ионами ОН- образуют нерастворимый гидроксид, то продуктом коррозии будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
4Fe(OH)2 + О2 = 4FeO(OH) + 2Н2О
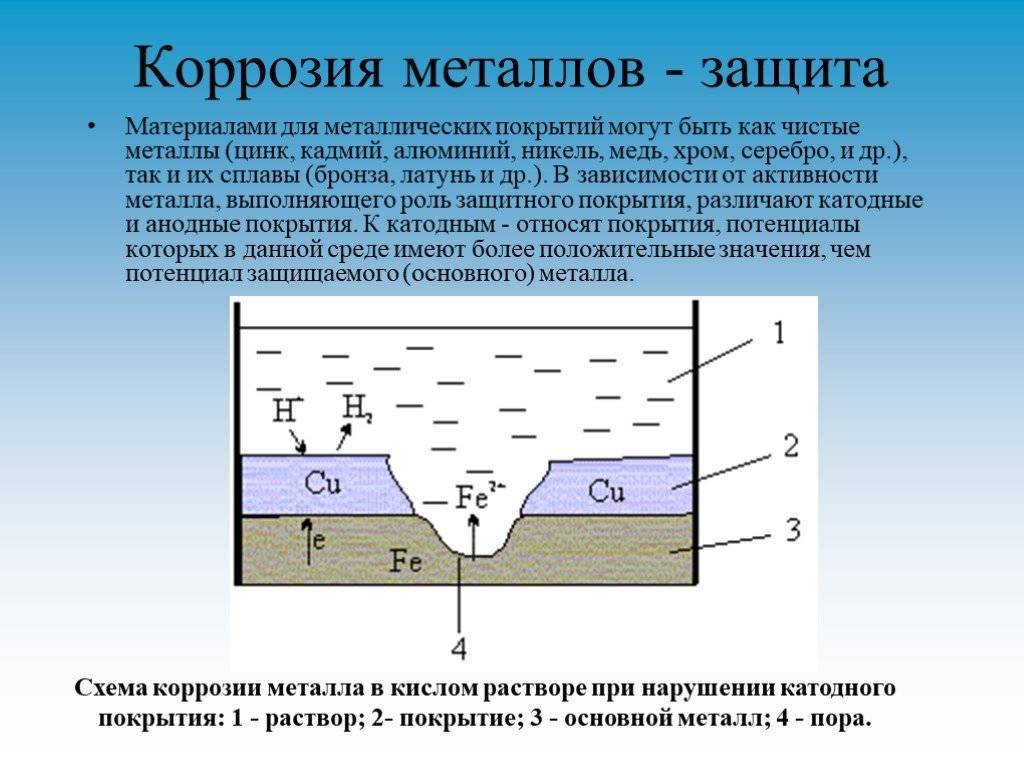
Так как никель имеет более электроположительный стандартный электродный потенциал, чем железо, то данное покрытие является катодным. При повреждении катодного покрытия (или наличия пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород. Следовательно, данное катодное покрытие может защищать железо от коррозии лишь при отсутствии пор и повреждений покрытия.
Суть катодной защиты
Главным врагом автомобиля, ограничивающим срок его службы, становятся вовсе не механические поломки, а общее ржавление металлического корпуса. Процесс коррозии железа, из которого сделана машина, невозможно свести к какой-то единичной химической реакции.

Напыляемая звукоизоляция коррозии
Разрушение металла, превращение его в безобразные рыжие пятна ржавчины, происходит в результате сочетания разнообразных факторов:
- особенности климата, в котором эксплуатируется автомобиль;
- химический состав воздуха, водяного пара и даже почв в районе (влияют на свойства дорожной грязи);
- качество материала кузова, наличие ударов и повреждений, проведенные ремонты, используемые защитные покрытия и десятки иных причин.
В самых общих чертах суть процессов коррозии машины можно объяснить таким образом.
Способы борьбы с коррозией
Коррозия металлов – это деструктивный, разрушающий кристаллическую решетку, окислительно-восстановительный химический процесс. Вызывается он чаще всего высокой химической активностью самих металлов – многие помнят из школьного курса химии «линейку» активности элементов. Активизироваться может при создании неблагоприятных условий, например, высокой влажности и опущенной температуре, в агрессивной солевой, кислотной или щелочной среде.
Чаще всего приходится сталкиваться с коррозией черных металлов, то есть – различных сортов стали и чугуна, применяемых буквально повсеместно, во всех сферах деятельности человека. Процесс начинает выдавать себя появлением на металлической поверхности пятен или разводов рыжего цвета.
Если с коррозией не бороться, она способна показать свою крайне разрушительную силу – металлические изделия быстро приходят в негодность.
Если не предпринять никаких шагов, то очаг начинает разрастаться, захватывая все новые площади. Причем иногда это происходит незаметно для глаз. Так, многие участки механизмов, приборов и т.п. — попросту скрыты из поля зрения, и увидеть их можно только при полной разборке узла или всего устройства. А иные очаги коррозии могут до поры скрываться под слоем краски, и только кода процесс зайдет очень далеко – поваляться сначала в виде вздутий, а потом – и прорывов ржавчины наружу.
Некоторые владельцы пытаются справиться с выявленными очагами коррозии механическим способом. То ест применяя шлифовку поврежденного ею участка наждачной бумагой или же специальными дисками, добравшись до «здорового» металла.
Однако подобная методика, если и может быть применена, то с исключительной осторожностью, и только в качестве предварительного этапа, перед нанесением специальных составов. Только механическая очистка является весьма малоэффективным средством. Точечные проявления коррозии, проступившие через слой краски
Точечные проявления коррозии, проступившие через слой краски
Особенно сложно удалить этим способом мелкие точечные очаги ржавчины, так как они в процессе чистки забиваются мелкодисперсной коррозийной пылью, и их становится практически не видно. Но беда как раз в том, что они никуда не деваются, и обязательно в дальнейшем проявят себя, даже после окрашивания. Поэтому обработка химическимисредствами — более надежна.
Кроме того, если ржавчиной поражен тонкий металл, то во время очистки, под давлением щёток или абразивного материала, он может повредиться вплоть до сквозной дырки.
В связи с этим рекомендуется пользоваться химическими составами, очищающими металл и предотвращающими появление коррозии в дальнейшем. Причем с их помощью можно даже успешно справиться с очагами в труднодоступных зонах, там, где никакими другими способами без разборки механизма к пораженному участку не добраться.
Преимущества и недостатки протекторной защиты
Преимуществами такого метода являются:
- простота, автономность и экономичность благодаря отсутствию источника тока и использованию магниевых, алюминиевых или цинковых сплавов;
- возможность формирования одиночных или групповых установок;
- возможность применения протекторной защиты, как для проектируемых объектов, так и для уже эксплуатируемых конструкций;
- организация защиты практически в любых условиях, где невозможно или нецелесообразно сооружать источники тока;
- при правильном использовании система может работать достаточно долго без всякого обслуживания;
- безопасность и возможность применения на взрывоопасных объектах (ввиду малости напряжений).
Но у такого вида защиты от ржавчины есть свои недостатки:
- Ограниченность применения способа в плохо проводящих ток средах.
- Безвозвратные потери протектора.
- Возможность загрязнения прилегающих территорий.

Электрохимические способы защиты от коррозии
Электрохимические способы защиты от коррозии широко используются в строительстве наземных и подземных сооружений.
В основе электрохимической защиты заложен закон сохранения заряда, то есть перехода заряда из одного состояния в другое.
В качестве заряда используется постоянный переход дополнительных электронов для восстановительного процесса металла с катода или анода, в зависимости от типа конструкции. Переход электронов происходит за счет создаваемой связки гальванического элемента.
Катодная защита
Этот тип защиты широко используют для защиты от коррозии подземных газопроводов, сооружений, резервуаров, а также для защиты аппаратуры промышленных предприятий.
Сущность метода заключается в катодной поляризации защищаемого металла: защищаемая конструкция подключается к отрицательному полюсу источника тока, а положительный полюс подключается к болванке металла, то есть к аноду.
Схема катодной защиты
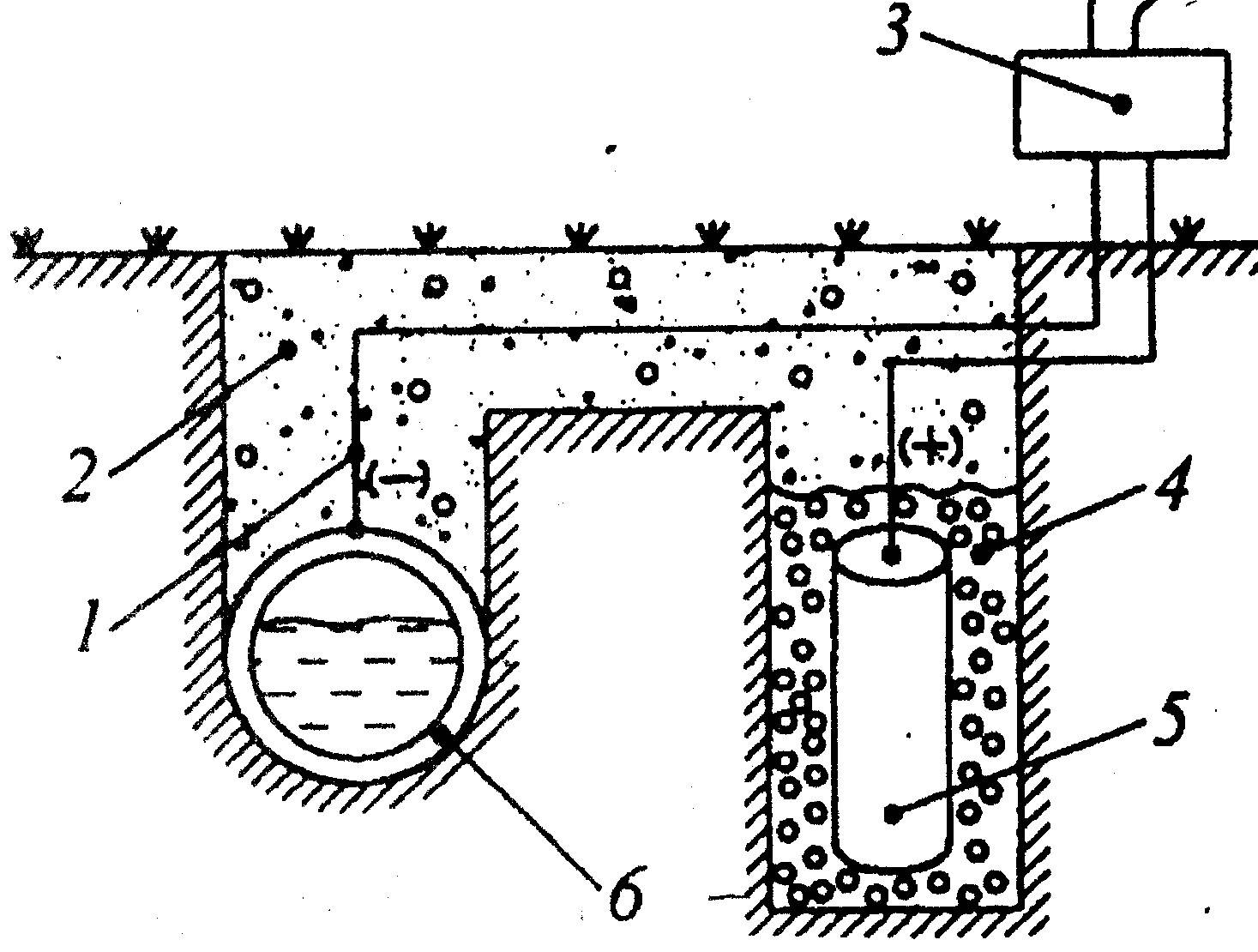
1 – стальной провод с изоляцией; 2 – грунт; 3 – выпрямитель; 4 – засыпка; 5 – вспомогательный анод; 6 – защищаемая конструкция (трубопровод).
При таком подключении защита конструкции происходит за счет постоянных восстановительных процессов, а окислительные процессы будут проходить на аноде (металлической болванке), то есть все разрушающие воздействия будут переходить на анод.
Если монтаж защиты осуществляется в агрессивный грунт, то около анода создается дополнительный токопроводящий слой из смеси кокса, хлорида натрия и сульфата кальция.
Катодная защита хорошо показывает себя для защиты конструкций в средне агрессивных грунтах
Протекторная защита
Универсальная защита трубопроводов, которая не требует стороннего источника питания.
В основу метода положены окислительно – восстановительные реакции.
Протектор (металлическая болванка) является анодом и со временем окисляется, то есть высвобождает электроны. Защищаемая конструкция находится в непрерывном процессе восстановления, так как является катодом.
Пока анод полностью не разрушится, конструкция будет в безопасности.
Схема протекторной защиты
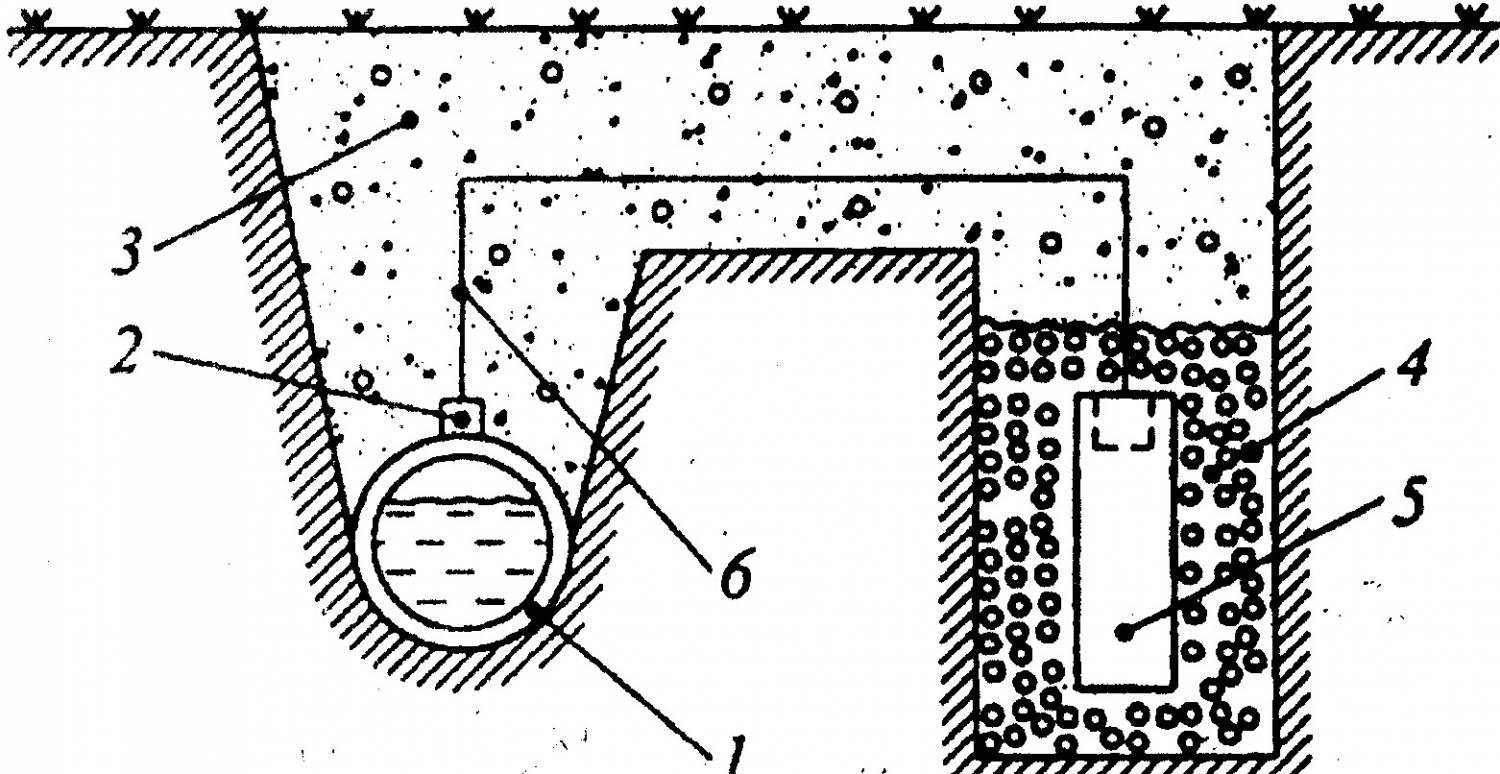
1 – защищаемая конструкция (трубопровод); 2 – стальной наконечник; 3 – грунт; 4 – засыпка (суспензия бентонита и алебастра); 5 – протектор; 6 – стальной провод с изоляцией.
Эффективность защиты определяется расстоянием, на котором может находиться протектор от защищаемой конструкции. Расстояние зависит от токопроводимости грунта, чем она выше, тем дальше можно расположить протектор.
Протекторную защиту как самостоятельный метод борьбы с коррозией используют редко, в основном она идет дополнением к неметаллическим изоляторам.
Анодная защита
Анодная защита используется в тех случаях, когда конструкция состоит из компонентов, которые могут при определенных условиях переходить в пассивное состояние.
За счет создание окислительно – восстановительной цепочки, в которой анодом будет конструкция, а катодом – металлическая болванка. Активатором процесса является источник постоянного тока, который будет создавать поляризацию.
Анодная защита используется в агрессивных средах с хорошей электрической проводимостью.
К пассивным компонентам слава относятся:
- хром;
- никель;
- титан;
- цирконий;
- железные сплавы.
Правила проведения обработки
Перед нанесением антикора необходимо подготовить поверхность. Требования к подготовке поверхности выдвигаются такие.
- Очаги ржавчины или потрескавшиеся краска или лак должны быть удалены.
- Поверхность должна быть очищена от грязи, масел и высушена.
- Нанесение антикоррозийного покрытия проводится с помощью специального пистолета, либо кистью или валиком.
На предприятиях же, где слишком завышено воздействие агрессивной среды, используется снижение ее воздействия путем:
- введения ингибиторов;
- удаления соединений, которые являются проводниками ржавчины.
https://youtube.com/watch?v=6LZ0jHSE_0Y
Существуют также СНиПы. Вот некоторые из них.
- Пропитка металла материалом с высокой химической стойкостью.
- Оклеивание специальной пленкой.
- Использование лакокрасочных материалов, оксидных и металлизированных покрытий.
В правилах по предупреждению конструкций от ржавления всегда указывается состав смесей в зависимости от того, в какой местности будут использоваться защищаемые изделия. Составы могут агрессивными, слабоагрессивными, либо неагрессивными вообще.
Локальная антикоррозийная защита
В правилах также указываются среды биологически активные или химически активные. А также они делятся на жидкие, твердые и газообразные.
В любом случае покраска изделия обязательна, так как она придает ему не только защитные свойства от коррозии, но и внешний эстетический вид.