Применение
Около 3⁄4 всего производимого редкоземельного металла используется как легирующий элемент при производстве сталей. Оставшаяся 1⁄4 часть используется в чистом виде и в химических соединениях. Применение он нашел во многих отраслях промышленности.
- Космическая область и авиастроение. Изделия из молибдена и его сплавов нашли применение для облицовки и изготовления головок ракет и носов самолетов, летающих на скоростях выше звуковых. Использование как конструкционный материал – это обшивка, а как тепловой экран – головная часть.
- Металлургия. Применение молибдена в литейном производстве и металлургии обусловлено высокой прокаливаемостью. Следовательно, повышается прочность, коррозионная стойкость, вязкость. В его сплавах с кобальтом или хромом заметно повышается твердость. Из легированных сталей с молибденовыми добавками изготавливаются ответственные детали. Его добавляют в жаро- и кислотоустойчивые сплавы. Поэтому большинство инструментов, производящих горячую обработку, изготавливаются из сталей, легированных Мо.
- Химическая промышленность. Из материалов с Мо, обладающих кислотоустойчивостью, изготавливают различные аппараты для производства кислот или их переработки. Нагреватели печей, внутри которых водородная среда также изготавливаются из молибденовых сплавов. Также данный металл можно найти в составе некоторых лаков, красок, эмалей и термически наносимых глазурей. Используют металл и как катализатор для химических реакций.
- Радиоэлектроника. Мо — незаменимый материал для изготовления электроосветительных и электронно-вакуумных приборов, среди которых многим известны радиолампы.
- Медицина. В медицине элемент используется при изготовлении рентгеновских аппаратов.
- Изделия из стекла. Из-за плавления при высокой температуре Мо используют при плавлении стекла.
Роль в растении
Биохимические функции
Молибден входит в состав немногих растительных белков. Он поступает в растения в форме аниона Mo2-4 и концентрируется в растущих, молодых организмах. Наибольшее его количество содержат бобовые, причем, в листьях его больше, чем в корнях и стеблях. В листовых пластинках молибден сосредоточен в составе хлоропластов.
Установлено, что корневые клубеньки содержат в несколько раз больше молибдена, чем ткани листьев. Значительная часть элемента в клубеньках связана с нитратредуктазой корней и стеблей и, кроме того, нитрогеназой клубеньковых бактерий. Молибден – важный компонент нитрогеназы и нитратредуктазы. Эти два молибденсодержащих фермента непосредственно участвуют в метаболизме азота, играя важную роль как в фиксации N2, так и в восстановлении оксида азота NO3. Потребность растений в молибдене непосредственно связана с обеспечением их азотом. Однако установлено, что растения, поглощающие NH4–N, испытывают гораздо меньшую потребность в молибдене, чем усваивающие NO3–N.
Молибден присутствует и в других ферментах (оксидазах), ускоряющих разнообразные, не связанные между собой реакции. Основная ферментативная роль молибдена непосредственно связана с функцией переноса электронов. Этому способствует переменная валентность Mo.
Молибден, как и железо, необходим для синтеза леггемоглобина (белка – переносчика кислорода в клубеньках). Его дефицит приводит к изменению цвета клубеньков на желтый или серый (нормальная окраска красная). Известно более 20 молибденосодержащих ферментов. Среди них альдегидоксидаза (катализирует превращение абсцизового альдегида в фитогормон абсцизовую кислоту), сульфитоксилаза (окисляет SO2-3 до SO2-4), ксантиндегидрогеназа и другие. Во всех вышеперечисленных ферментах молибден присутствует в виде молибдоптерина, именуемого молибденовым фактором, что обеспечивает устойчивость молибдена к окислению.
Недостаток (дефицит) молибдена в растениях
Симптомы дефицита молибдена проявляются у растений, находящихся на кислых минеральных почвах с высоким содержанием гидроксидов марганца и железа. Обострение дефицита вызывает присутствие в почвенном растворе сульфатных анионов, конкурирующих с анионами молибдата. Критический уровень содержания молибдена в растениях колеблется от 0,1 до 1 мг/кг сухой массы листьев.
Изменение внутреннего строения
При дефиците молибдена растения становятся неустойчивы к низким температурам и дефициту воды. Наблюдаются нарушения в формировании пыльцы.
Внешние признаки
Например, у капусты пятнистость сопровождается увяданием краев листьев, а у томата и картофеля листовые пластинки закручиваются.
Недостаток молибдена негативно сказывается и на формировании цветков. У томатов они мельчают, почти сидят на стебле и не раскрываются, у цветной капусты деформируются и становятся рыхлыми. У бобовых при недостатке данного элемента нарушается образование клубеньков на корнях.
Избыток молибдена
Фитотоксичность молибдена проявляется только в очень высоких его концентрациях. Например, признаки молибденового отравления молодых проростков ячменя отмечались при содержании Mo 135 мг/кг сухой массы.
Избыток молибдена в растениях токсичен для животных и человека. Применять молибденовые микроудобрения следует с учетом токсичности этого элемента для животных и человека, проявляющейся даже при крайне низких концентрациях. Особенно это характерно для кормовых растений.
Молибден – малораспространенный элемент. Молибденовые удобрения получают из молибденовых руд. Массовая доля металла в них составляет 0,1–1 %. В дополнение к этому источнику, значительную часть молибдена добывают из различных отходов промышленности, в частности, электролампового производства.
Достоинства / недостатки
- Достоинства:
- имеет высокую точку плавления, а следовательно — жаропрочность;
- т.к. плотность данного металла (10200 кг/м3) почти в два раза меньше плотности вольфрама (19300 кг/м3), то сплавы на основе молибдена обладают значительно большей удельной прочностью (при температурах ниже 1370 °С);
- имеет высокий модуль упругости;
- малый температурный коэффициент расширения;
- обладает хорошей термостойкостью;
- малое сечение захвата тепловых нейтронов;
- для молибдена характерна высокая коррозионная стойкость. Данный металл устойчив в большей части щелочных растворов, а также в серной, соляной и плавиковой кислотах при разных температурах и концентрациях.
- Недостатки:
- обладает небольшой окалийностью;
- высокая хрупкость сварных швов;
- малая пластичность при низких температурах;
- упрочнение нагартовкой можно использовать лишь до 700-800 °С, при более высоких температурах происходит разупрочнение из-за возврата.
Тугоплавкий металл молибден
Молибден и его сплавы относятся к тугоплавким материалам. Для изготовления обшивки головных частей ракет и самолетов тугоплавкие металлы и сплавы на их основе используют в двух вариантах. В одном из вариантов эти металлы служат лишь тепловыми экранами, которые отделены от основного конструкцнонного материала теплоизоляцией. Во втором случае тугоплавкие металлы и их сплавы служат основным конструкционным материалом. Молибден занимает второе место после вольфрама и его сплавов по прочностным свойствам. Однако, по удельной прочности при температурах ниже 1350-1450°С Mo и его сплавы занимают первое место. Таким образом, наибольшее распространение для изготовлеиия обшивки и элементов каркаса ракет и сверхзвуковых самолетов получают молибден и ниобий и их сплавы, обладающие большей удельной прочностью до 1370°С по сравненню с танталом, вольфрамом и сплавами на их основе. Из Mo изготовляют сотовые панели космических летательных аппаратов, теплообменники, оболочки возвращающихся на землю ракет и капсул, тепловые экраны, обшивку кромок крыльев и стабилизаторы в сверхзвуковых самолетах. В очень тяжелых условиях работают некоторые детали прямоточных ракетных и турбореактивных двигателей (лопатки турбин, хвостовые юбки, заслонки форсунок, сопла ракетных двигателей, поверхности управления в ракетах с твердым топливом). При этом от материала требуется не только высокое сопротивление окислению и газовой эрозии, но и высокая длительная прочность и сопротивление удару. При температурах ниже 1370°С для изготовления данных деталей используют молибден и его сплавы.
Молибден — перспективный материал для оборудования, работающего в среде серной, соляной и фосфорной кислот. В связи с высокой стойкостью данного металла в расплавленном стекле его широко используют в стекольной промышленности, в частности для изготовления электродов для плавки стекла. В настоящее время из молибденовых сплавов изготавливают прессформы и стержни машин для литья под давлением алюминиевых, цинковых и медных сплавов. Высокая прочность и твердость таких материалов при повышенных температурах обусловили их применение в качестве инструмента при горячей обработке сталей и сплавов давлением (оправки прошивных станов, матрицы, прессштемпели).
Молибден существенно улучшает свойства сталей. Присадка Mo значительно повышает их прокаливаемость. Небольшие добавки Mo (0,15-0,8 %) в конструкционные стали настолько увеличивают их прочность, вязкость и коррозионную стойкость, что они используются при изготовлении самых ответственных деталей и изделий. Для повышения твердости молибден вводят в сплавы кобальта и хрома (стеллиты), которые применяют для наплавки кромок деталей из обычной стали, работающих на износ (истирание).Также он входит в состав ряда кислотоупорных и жаростойких сплавов на основе никеля, кобальта и хрома.
Еще одной областью применения является производство нагревательных элементов электропечей, работающих в атмосфере водорода при температурах до 1600°С. Также молибден широко используется в радиоэлектронной промышленности и рентгенотехнике для изготовления различных деталей электронных ламп, рентгеновских трубок и других вакуумных приборов.
Соединения молибдена — сульфид, оксиды, молибдаты — являются катализаторами химических реакций, пигментами красителей, компонентами глазурей. Также данный металл как микродобавка входит в состав удобрений. Гексафторид молибдена применяется при нанесении металлического Mo на различные материалы. МоSi2 используется как твердая высокотемпературная смазка. Чистый монокристаллический Mo используется для производства зеркал для мощных газодинамических лазеров. Теллурид молибдена является очень хорошим термоэлектрическим материалом для производства термоэлектрогенераторов (термо-э.д.с 780 мкВ/К). Трехокись молибдена (молибденовый ангидрид) широко применяется в качестве положительного электрода в литиевых источниках тока. Дисульфид MoS2 и диселенид МоSе2 молибдена используют в качестве смазки трущихся деталей, работающих при температурах от -45 до +400°С. В лакокрасочной и легкой промышленности для изготовления красок и лаков и для окраски тканей и мехов в качестве пигментов применяют ряд химических соединений Mo.
Свойства молибдена (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Молибден |
| 102 | Прежнее название | |
| 103 | Латинское название | Molybdaenum |
| 104 | Английское название | Molybdenum |
| 105 | Символ | Mo |
| 106 | Атомный номер (номер в таблице) | 42 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, тяжёлый металл |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1778 г. |
| 110 | Год открытия | 1778 г. |
| 111 | Внешний вид и пр. | Блестящий металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00011 % |
| 120 | Содержание в морях и океанах (по массе) | 1,0·10-6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 5,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 9,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,00012 % |
| 124 | Содержание в организме человека (по массе) | 0,00001 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 95,96(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d5 5s1 |
| 203 | Электронная оболочка | K2 L8 M18 N13 O1 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 190 пм |
| 205 | Эмпирический радиус атома* | 154 пм |
| 206 | Ковалентный радиус* | 154 пм |
| 207 | Радиус иона (кристаллический) | Mo3+ 83 (6) пм, Mo4+ 79 (6) пм Mo5+ 75 (6) пм, Mo6+ 73 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 42 электрона, 42 протона, 54 нейтрона |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 6-ая группа (по старой классификации – побочная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, -1, 0, +1,+2, +3, +4, +5, +6 |
| 302 | Валентность | II, III, IV, V, VI |
| 303 | Электроотрицательность | 2,16 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 684,32 кДж/моль (7,09243(4) эВ) |
| 305 | Электродный потенциал | Mo3+ + 3e– → Mo, Eo = -0,2 В |
| 306 | Энергия сродства атома к электрону | 71,9 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 10,28 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 9,33 г/см3 (при температуре плавления 2623 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 2623 °C (2896 K, 4753 °F) |
| 403 | Температура кипения* | 4639 °C (4912 K, 8382 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 37,48 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 598 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,251 Дж/г·K (при 25 °C), 0,272 Дж/г·K (при 0-100 °C) |
| 410 | Молярная теплоёмкость* | 24,06 Дж/(K·моль) |
| 411 | Молярный объём | 9,4 см³/моль |
| 412 | Теплопроводность | 138 Вт/(м·К) (при стандартных условиях), 138 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
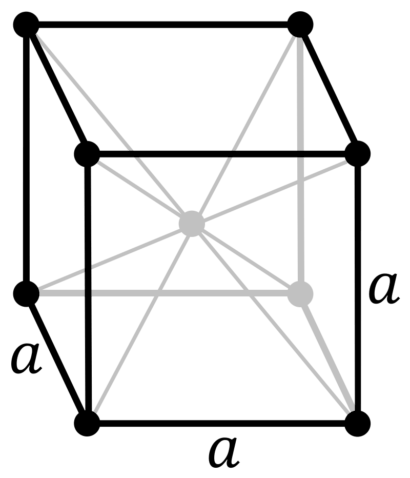
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,147 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 450 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-98-7 |
Примечание:
205* Эмпирический радиус атома молибдена согласно и составляет 139 пм.
206* Ковалентный радиус молибдена согласно и составляет 154±5 пм и 130 пм соответственно.
401* Плотность молибдена согласно и составляет 10,22 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления молибдена согласно составляет 2620 °С (2893,15 K, 4748 °F).
403* Температура кипения молибдена согласно и составляет 4611,85 °С (4885 K, 8333,33 °F) и 4630 °С (4903,15 K, 8366 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) молибдена согласно и составляет 28 кДж/моль и 36,4 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) молибдена согласно составляет 582,4 кДж/моль.
410* Молярная теплоёмкость молибдена согласно составляет 23,93 Дж/(K·моль).
Молибден
Молибден по классификации в периодической таблице Менделеева относится к IV группе элементов. Имеет атомарный номер 42, а масса его атома равна 95,94. принято обозначать символом «Мо».
Молибден – это редкоземельный металл. Его объем составляет порядка 0,00011% от общей массы земли. В чистом виде имеет стальной сероватый цвет, в диспергированном – серовато-черный.
Молибден, как металл, в природе не встречается. Он содержится в минералах, которых на сегодняшний день известно порядка двадцати. Преимущественно это молибдаты, которые образуются в кислотной магме и гранитоидах.
Молибден
Получение молибдена
Сырье, из которого производится металлический молибден – молибденовые концентраты. В их составе данного элемента содержится около 50%. Также в них содержатся: сера ~ 30%, оксид кремния (до 9%) и около 20% прочих примесей.
Предварительно концентрат обжигают с целью дополнительного окисления. Процесс проводят в печах двух типов: многоподовых или кипящего слоя. Температура обжига 570 °С — 600 °С. В результате чего получается огарок — МоО3 и примеси.
На следующем этапе удаляют примеси для получения чистого оксида молибдена. Применяются два способа:
- Возгонка при температуре 950 °С — 1100 °С.
- Химическое выщелачивание. Суть способа в том, что при взаимодействии с аммиачной водой устраняются примеси меди и железа и получается карбид молибдена, который кристаллизуют выпаркой или нейтрализацией. Далее карбид нагревают и выдерживают при температуре до 500°С. На выходе – чистый оксид МоО3, в котором содержание примесей всего 0,05%.
Производство молибдена основано на восстановлении МоО3. Процесс проводят в два этапа:
- В трубчатой печи при температуре 550°С — 700°С в потоке сухого водорода происходит отделение атомов кислорода.
- Далее температура поднимается до 900°С — 1000°С и происходит окончательное восстановление. Полученный металл находится в виде порошка.
Для получения монолитного металла пользуются плавлением или спеканием порошка. Плавку используют, когда получают заготовки массой от 500 кг. Процесс производят в дуговых печах с охлаждаемым тигелем, в который подается расходуемый электрод из ранее спеченных штабиков.
Известно около 20 минералов молибдена. Важнейшие из них: молибденит MoS2 (60 % Mo), повеллит CaMoO4 (48 % Mo), молибдит Fe(MoO4)3·nH2O (60 % Mo) и вульфенит PbMoO4.
Месторождения
Крупные месторождения молибдена известны в США, Мексике, Чили, Канаде, Австралии, Норвегии, России. В России молибден выпускают на Сорском ферромолибденовом заводе. Более 7 % от мировых запасов молибдена расположены в Армении, причем 90 % из них сосредоточены в Каджаранском медно-молибденовом месторождении.
В космосе
Аномально высокое содержание молибдена наблюдается в звёздных образованиях, состоящих из красного гиганта (или сверхгиганта), внутри которого находится нейтронная звезда — объектах Ландау — Торна — Житковой.
Добыча
Залежи молибдена и его добыча по странамСтранаЗалежи (тыс. т)20012002200320042005200620072014
| США | 2700 | 37,6 | 32,3 | 29,9 | 41,5 | 58,0 | 59,8 | 59,4 | 68,2 |
| Китай | 3000 | 28,2 | 30,33 | 32,22 | 29,0 | 40,0 | 43,94 | 46,0 | 103,0 |
| Чили | 1905 | 33,5 | 29,5 | 33,4 | 41,48 | 47,75 | 43,28 | 41,1 | 48,8 |
| Перу | 850 | 8,35 | 8,32 | 9,63 | 9,6 | 17,32 | 17,21 | 17,25 | 17,0 |
| Канада | 95 | 8,56 | 7,95 | 8,89 | 5,7 | 7,91 | 7,27 | 8,0 | 9,7 |
| Россия | 360 | 3,93 | 4,29 | 3,57 | 3,11 | 3,84 | 3,94 | 4,16 | 4,8 |
| Мексика | 135 | 5,52 | 3,43 | 3,52 | 3,7 | 4,25 | 2,52 | 4,0 | 14,4 |
| Армения | 635 | 3,4 | 3,6 | 3,5 | 3,0 | 2,75 | 3,0 | 3,0 | 7,1 |
| Иран | 120 | 2,6 | 2,4 | 2,4 | 1,5 | 2,0 | 2,0 | 2,5 | 4,0 |
| Монголия | 294 | 1,42 | 1,59 | 1,6 | 1,7 | 1,19 | 1,2 | 1,5 | 2,0 |
| Узбекистан | 203 | 0,58 | 0,5 | 0,5 | 0,5 | 0,57 | 0,6 | 0,5 | 0,5 |
| Болгария | 10 | 0,4 | 0,4 | 0,2 | 0,2 | 0,2 | 0,4 | 0,4 | ? |
| Казахстан | 130 | 0,09 | 0,05 | 0,05 | 0,23 | 0,23 | 0,25 | 0,4 | — |
| Киргизия | 100 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | ? |
| Прочие | 1002 | — | — | — | — | — | — | — | — |
| Итого | 11539 | 134,4 | 124,91 | 129,63 | 141,47 | 186,26 | 185,66 | 188,71 |
Генетические группы и промышленные типы месторождений
1. Контактово-метасоматические (скарновые).
2. Гидротермальные.
А. Высокотемпературные (грейзеновые).Б. Среднетемпературные.а. кварц-молибденитовые.б. кварц-сфалерит-галенит-молибденитовые.в. кварц-халькопирит-молибденитовые (меднопорфировые руды).г. настуран-молибденитовые.
Получение
Промышленное получение молибдена начинается с обогащения руд флотационным методом. Полученный концентрат обжигают до образования оксида MoO3:
2MoS2 + 7O2 ⟶ 2MoO3 + 4SO2 ,
который подвергают дополнительной очистке. Далее MoO3 восстанавливают водородом:
MoO3 + 3H2 ⟶ Mo + 3H2O
Полученные заготовки обрабатывают давлением (ковка, прокатка, протяжка).
Дефицит молибдена — симптомы и признаки
Что вызывает дефицит молибдена? Нехватка молибдена встречается редко, но если он действительно возникает, то обычно приобретается или наследуется.
Диетическая недостаточность этого минерала никогда не наблюдалась у здоровых людей. Однако пациенты с генетическим и тяжелым метаболическим дефектом, называемым дефицитом кофактора молибдена, имеют это состояние ().
Это редкое заболевание приводит к дефициту трех молибдоферментов (сульфитоксидаза, ксантиндегидрогеназа и альдегидоксидаза). Младенец, родившийся с этим дефицитом кофактора, который может выжить, может иметь серьезные неврологические нарушения и целый ряд других нарушений.
Если дефицит все же возникает, это может быть приобретенный дефицит. Это было замечено у одного пациента в 1980-х годах, у которого была болезнь Крона и которая находилась на длительном внутривенном введении пищи без добавления уровней этого минерала.
Для этого пациента симптомы дефицита молибдена включали учащенное сердцебиение и частоту дыхания, головные боли и ночную слепоту. Состояние пациента улучшилось, когда внутривенное питание было прекращено и заменено добавлением молибдена в форме молибдата аммония.
Недостаток молибдена для организма считается крайне редким, поэтому добавка обычно не рекомендуется к приему.
Удельное сопротивление (при 20° C)
| Вещество | Уровень удельного сопротивления, мкОм • мм2/м |
| Алюминий | 0,028 |
| Вольфрам | 0,055 |
| Железо | 0,098 |
| Золото | 0,023 |
| Константан | 0,44−0,52 |
| Латунь | 0,025−0,06 |
| Манганин | 0,42−0,48 |
| Медь | 0,0175 |
| Молибден | 0,057 |
| Никелин | 0,39−0,45 |
| Никель | 0,100 |
| Олово | 0,115 |
| Ртуть | 0,958 |
| Свинец | 0,221 |
| Серебро | 0,016 |
| Тантал | 0,155 |
| Фехраль | 1,1−1,3 |
| Хром | 0,027 |
| Цинк | 0,059 |
| Вещество | К | Вещество | К |
| Алюминий | 0,0042 | Олово | 0,0042 |
| Вольфрам | 0,0048 | Платина | 0,004 |
| Константан | 0,2 | Ртуть | 0,0009 |
| Латунь | 0,001 | Свинец | 0,004 |
| Медь | 0,0043 | Серебро | 0,0036 |
| Манганин | 0,3 | Сталь | 0,006 |
| Молибден | 0,0033 | Тантал | 0,0031 |
| Никель | 0,005 | Хром | 0,006 |
| Никелин | 0,0001 | Фехраль | 0,0002 |
| Нихром | 0,0001 | Цинк | 0,004 |
Сплавы сопротивления
- Константан (58,8 Cu, 40 Ni, 1,2 Mn)
- Манганин (85 Cu, 12 Mn, 3 Ni)
- Нейзильбер (65 Cu, 20 Zn, 15 Ni)
- Никелин (54 Cu, 20 Zn, 26 Ni)
- Нихром (67,5 Ni, 15 Cr, 16 Fe, 1,5 Mn)
- Реонат (84Cu, 12Mn, 4 Zn)
- Фехраль (80 Fe, 14 Cr, 6 Al)
Удельное сопротивление нихрома
Рассмотрим электронную теорию данного явления. При движении по проводнику свободные электроны постоянно встречают на своем пути другие электроны и атомы. Взаимодействуя с ними, свободный электрон теряет часть своего заряда. Таким образом, электроны сталкиваются с сопротивлением со стороны материала проводника. Каждое тело имеет свою атомную структуру, которая оказывает электрическому току разное сопротивление. Единицей сопротивления принято считать Ом.
Сопротивление каждого отдельно взятого проводника (обозначается R или r.) зависит от свойств материала, из которого он изготовлен. Для точной характеристики электрического сопротивления того или иного материала было введено понятие — удельное сопротивление (нихрома, алюминия и т. д.). Удельным считается сопротивление проводника длиной до 1 м, сечение которого — 1 кв. мм. Этот показатель обозначается буквой p. Каждый материал, использующийся в производстве проводника, обладает своим удельным сопротивлением. Для примера рассмотрим удельное сопротивление нихрома и фехрали.
- Х15Н60 — 1.13 Ом * мм2/м
- Х23Ю5Т — 1.39 Ом* мм2/м
- Х20Н80 — 1.12 Ом* мм2/м
- ХН70Ю — 1.30 Ом* мм2/м
- ХН20ЮС — 1.02 Ом* мм2/м
Применение
Высокий уровень удельное сопротивления нихрома, фехрали позволяет использовать эти материалы в произвгоодстве нагревательных элементов. Самая распространенная продукция — нихромовая нить, лента, полоса Х15Н60 и Х20Н80, а также фехралевая проволока Х23Ю5Т. для приборов теплового действия, бытовых приборов и электронагревательных элементов промышленных печей.
Обработка молибдена
Обработка молибдена затруднена в связи с низкой вязкостью при низкой температуре. Также он имеет малую эластичность, по этому для его обработки используются следующие методы:
- горячее деформирование:
- ковка;
- прокатка;
- протяжка;
- термическая обработка;
- механическая обработка.
Во время обработки маленьких заготовок применяются обжимные машины. Большие заготовки прокатываются на малых станах или получают форму на протяжных станках.

Внешний вид молибдена
Если появляется потребность обработки механическим способом резанием, то механическая обработка молибдена проводится инструментом, сделанным из марок быстрорежущих сталей. Заточка углов инструмента при токарной отделке должна подходить углам заточки для обработки чугуна.
Термическая обработка молибдена отличается высокой прокаливаемостью из-за его содержания в сталях. Проведенная закалка увеличивает твердость и устойчивость к изнашиванию ответственных деталей.