Лайфхак: как выучить таблицу химических элементов
Существует один весьма распространённый и устойчивый миф о том, что Дмитрий Менделеев открыл свою таблицу химических элементов во сне.
Друзья мои! Нужно быть совершенно недалёкого представления об учёных, чтобы утверждать о том, что научные открытия можно делать во сне или случайно. Известно высказывание самого Дмитрия Ивановича: «Я над ней (таблицей элементов — прим. Учёного Кота), может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
А пытались-то многие!
Попытки классифицировать и систематизировать химические элементы возникали задолго до Менделеева. Первую значимую попытку в 1829 году сделал немецкий химик Иоганн Вольфганг Дёберейнер, затем его труды развил другой немец — Леопольд Гмелин. Во Франции определённых успехов достиг химик-геолог Александр де Шанкуртуа. Однако все эти работы не выдерживали научной критики, как например, не смогла устоять система элементов, предложенная англичанином Джоном Ньюлендсом.
Лишь в 1869 году на заседании Русского химического комитета было заслушано сообщение Дмитрия Менделеева об открытии им фундаментального закона природы — Периодического закона. В том же году вышел его учебник «Основы химии», в котором впервые этот закон был представлен в виде таблицы.
Конечно же и труды Меделеева подверглись жесточайшей научной критике! Его идеи не сразу признавались научным сообществом. Лишь только после того, как были открыты новые химические элементы, предсказанные ранее Менделеевым, например, галлий, скандий, германий, Периодический закон был окончательно признан, как одна из теоретических основ химии.
Первый способ: «раскраска»
Так как легко и просто выучить периодическую таблицу химических элементов Менделеева?
Первым способом можно начать знакомство с периодической таблицей ещё в детстве. Подберите карандаши соответствующего цвета, наклейте наклеечки с названиями элементов и дайте ребёнку раскрашивать таблицу.
Второй способ: «Морской бой»
Второй способ более интересней. Многие наверняка знакомы с игрой «Морской бой». Распечатайте таблицу и обозначьте цифрами и буквами вертикали и горизонтали. «Морской бой» начинается!
Со временем можно усложнять игру — например, перестать нумеровать столбцы и строки. И играть, называя только названия:
- Селен!
- Ранил…
- Теллур!
- Ранил…
- Полоний!
- Убил.
Если идти по дальнейшему пути усложнения игры, то вместо названия химических элементов, можно называть его атомную или молекулярную массу.
Попробуйте! Вы будете лучше ориентироваться в таблице!
Примечания и ссылки
- Иногда они написаны лантаноиды в связи с ИЮПАК по рекомендации для вызова этих элементов лантаноиды на английском языке для того , чтобы избежать путаницы с минеральными анионами , которые на английском языке имеют суффикс -ide : фторид для ионов фторида F – , хлорид для ионов хлора Cl – , галогенид для галогенида , сульфида для сульфида и т. д. В английском языке эта рекомендация мало соблюдается, во французском она тем более, тем более что в нашем языке не существует путаницы с минеральными анионами.
- (in) , раздел 1: Основные константы, единицы и коэффициенты преобразования , подраздел: Электронная конфигурация нейтральных атомов в основном состоянии , 84- е онлайн-издание, CRC Press, Бока-Ратон, Флорида, 2003.
- (in) Родерик П. Макдональд , Использование фильтра из оксида гольмия в спектрофотометрии , Clinical Chemistry , Vol. 10, декабрь 1964, стр. 1117-1120
- (in) Альберт К. Левин и Фрэнк С. Палилла , Новый высокоэффективный катодолюминесцентный люминофор с красным светом (YVO 4: Eu) для цветного телевидения » , Applied Physics Letters , vol. 5, п о 6,15 сентября 1964 г., стр. 118-120
- (in) Мэтью Р. Макдональд, Джефферсон Э. Бейтс, Джозеф В. Циллер, Филипп Фурче и Уильям Дж. Эванс , Завершение серии двух ионов лантаноидов для элементов: синтез молекулярных комплексов Pr 2+ , Gd2 +., Tb 2+ и Lu 2+ » , Журнал Американского химического общества , т. 135, п о 26,3 июля 2013 г., стр. 9857-9868
Нахождение в природе
С точки зрения нахождения в природе лантаноиды делятся на 2 группы: цериевую ( Ce, Pr, Nd, Pm, Sm, Eu) и иттриевую ( Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu). Данный раздел основывается на том, что в одних минералах встречаются преимущественно церий и его “группа”, а в других – иттрий вместе с остальными элементами. К минералам цериевой группы относится монацит (Это, La, Nb ….) PO 4. Он образует россыпи монацитового песка, куда, кроме него, входит кварц, рутил, оксид тория. В монацитового песка содержатся все минералы цериевой группы. Элементы этой же группы содержатся в изоморфных фторокарбонатах (Это, La ….) FCO 3 (бастнезит), а также в собственном силикате Ce 2 Si 2 O 7 (церит). К минералам иттриевой группе относится ксенотим (Y, Eu, Gd, …) РО 4, в котором лантаноиды изоморфно замещают друг друга.
Второй по важности редкоземельный минерал – бастнезит – во многом похож на него. Бастнезит тоже тяжелый, тоже блестящий, тоже не постоянен по окраске (чаще всего ярко-желтый)
Но химически с монацита его объединяет только большое содержание лантана и лантаноидов
Если монацит – фосфат, то бастнезит – фторокарбонат редких земель, его состав обычно записывают так: (La, Се) FCO 3. Но, как часто бывает, формула минерала не полностью отражает его состав. В данном случае она указывает лишь на главные компоненты: в бастнезити 36,9-40,5% оксида церия и почти столько же (в сумме) оксидов лантана, празеодима и неодима. Но обычно в нем есть и другие лантаноидов
Но химически с монацита его объединяет только большое содержание лантана и лантаноидов. Если монацит – фосфат, то бастнезит – фторокарбонат редких земель, его состав обычно записывают так: (La, Се) FCO 3. Но, как часто бывает, формула минерала не полностью отражает его состав. В данном случае она указывает лишь на главные компоненты: в бастнезити 36,9-40,5% оксида церия и почти столько же (в сумме) оксидов лантана, празеодима и неодима. Но обычно в нем есть и другие лантаноидов.
Есть даже селективный неодимовый минерал – ешинит. В этот минерал входят окислы кальция, тория, тантала, ниобия, иттрия, лантана и лантаноидов, из которых в нем больше церия и неодима.
Лантаноиды распространены в природе не одинаково. Наиболее труднодоступные лантаноиды – тербий, тулий, лютеций (все это лантаноиды с нечетными атомными номерами) – стоят дороже золота и платины.
Ресурсы лантанидов довольно значительны – суммарный массовое содержание лантанидов (вместе с лантаном) в земной коре 0,01%, что близко к содержанию меди. Наиболее распространенными являются La, Ce i Nd. Известно более 250 минералов, содержащих лантаниды. Из них собственных минералов лантанидов – 60-65 (содержание редких земель более 5-8%). Это главным образом фосфаты, лития или флуорокарбонаты, титанониобаты. Важнейшие минералы, содержащие лантаниды: монацит, ксенотим, бастнезит, гадолинит, ортит, лопарит, евксенит, фергусонит, самарскит. Лантаниды концентрируются в различных типах магматогенных, осадочных и метаморфогенных месторождений.
В Украину руды лантанидов не добываются. Потребности страны (ок. 100 т / год) покрывает импорт. Промышленные концентрации лантанидов обнаружены в юго-восточной и юго-западной частях Украинского щита.
§ 10. Периодический закон в свете теории строения атома
*Положение в периодической системе d- и f-элементов
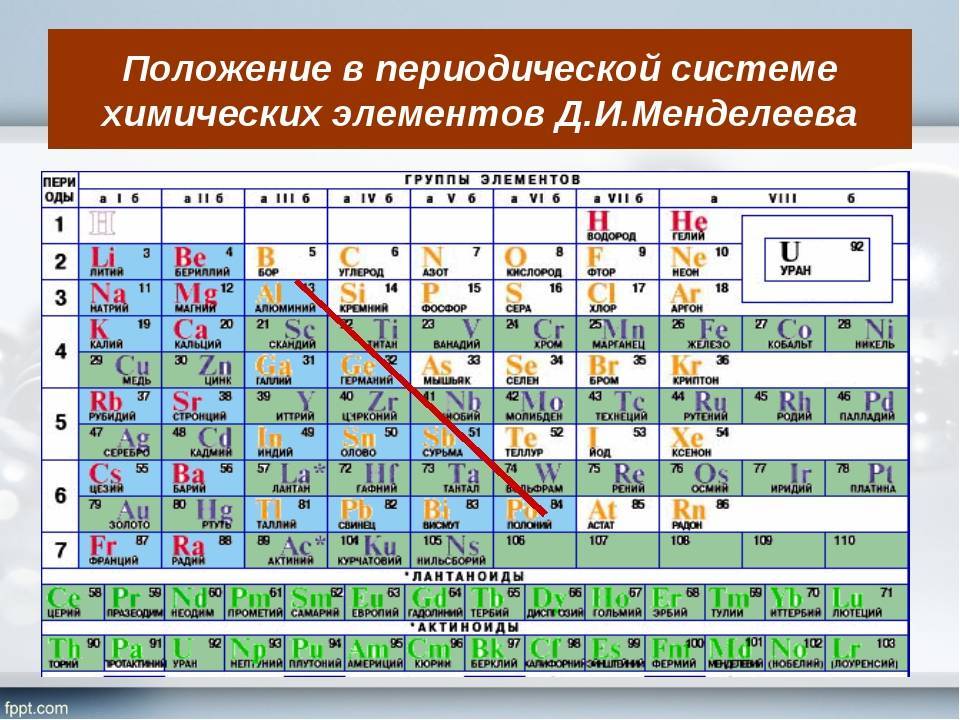
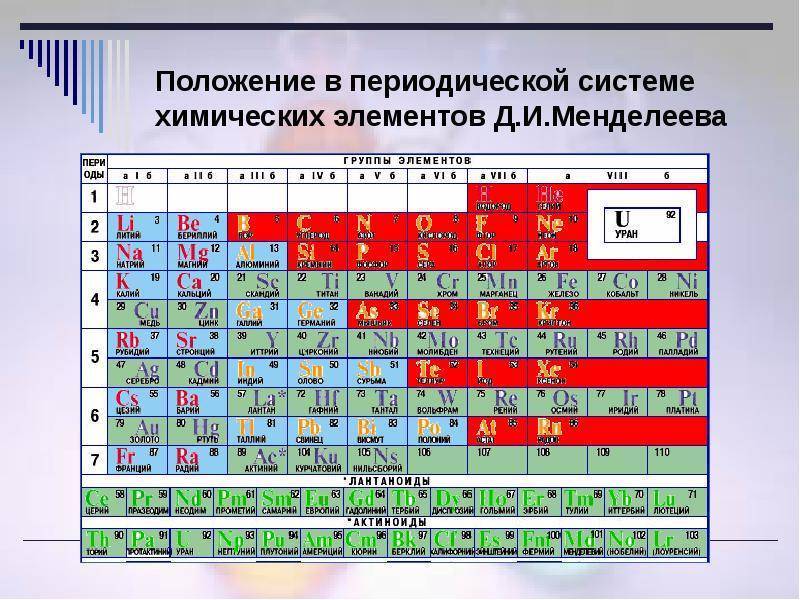
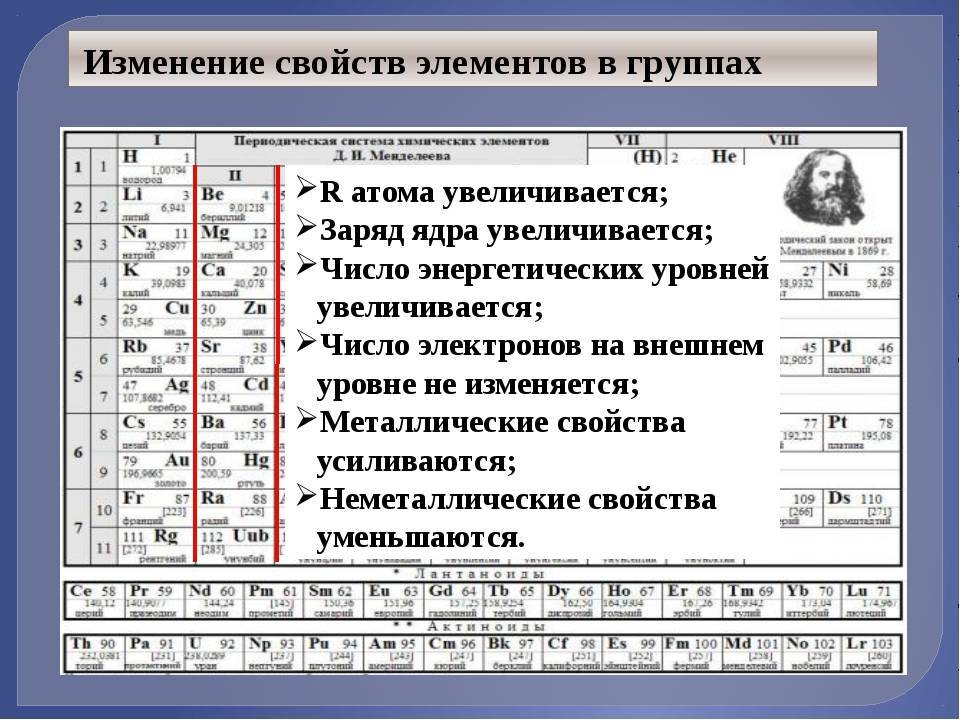
d– и f-Элементы относят к элементам B-групп. Так как эти элементы расположены в периодической системе между s– и p-элементами в 4–8-м периодах, их называют переходными.
В 4-м периоде (K — Kr) содержится 18 элементов. Ввиду большего числа элементов в этом периоде по сравнению с первыми тремя периодами Д. И. Менделеев назвал 4-й и последующие периоды большими.
Пятый период (Rb — Xe) построен аналогично 4-му: в нём также находится десять переходных d-элементов (Y — Cd).
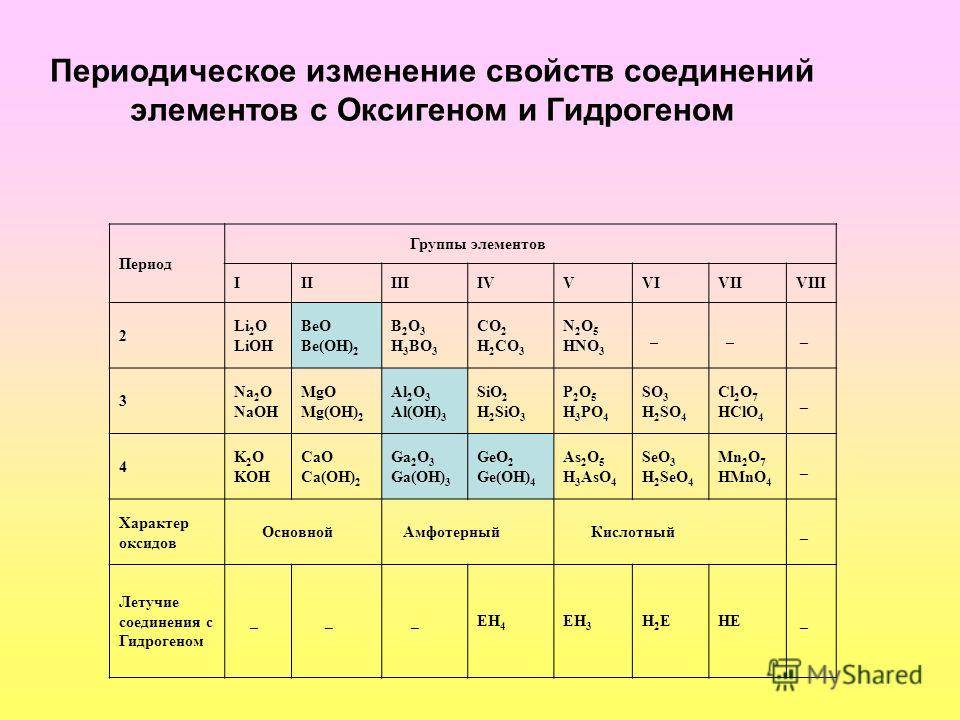
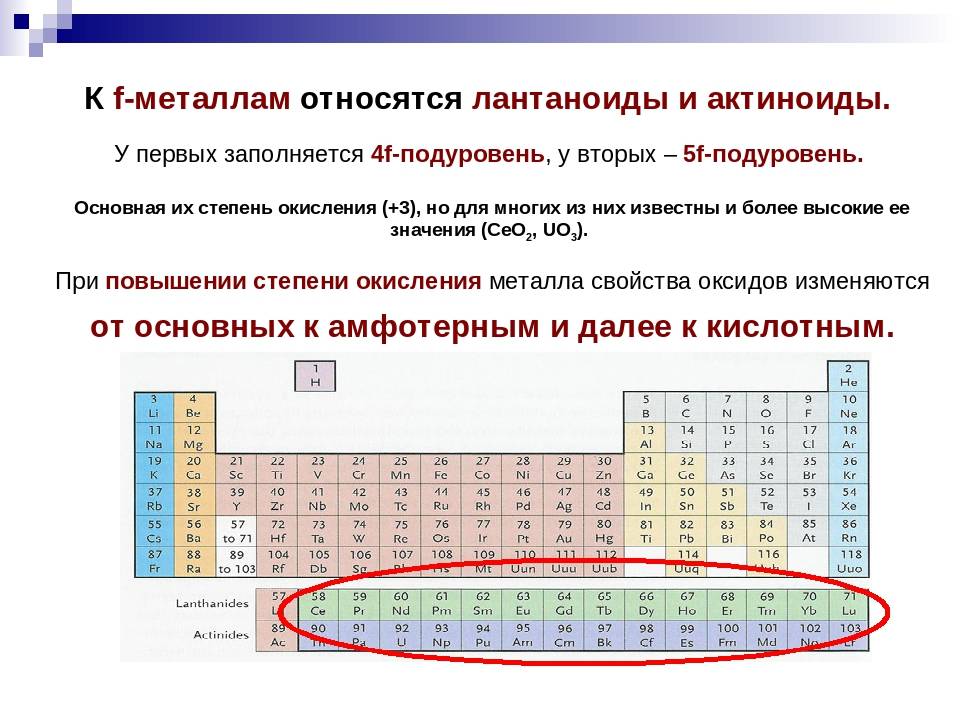
Шестой период (Cs — Rn) содержит 32 элемента. В него, помимо десяти d-элементов (Lu — Hg), включено 14 f-элементов. Элементы от лантана (La) до иттербия (Yb) в виде отдельного ряда вынесены вниз таблицы, который получил название «лантаноиды» по его первому элементу — лантану. Лантаноиды сходны по химическим свойствам. Это объясняется тем, что электронами у них заполняются внутренние 4f-орбитали, а валентный электронный слой имеет похожую электронную конфигурацию — чаще всего 5d16s2. В соединениях лантаноиды проявляют преимущественно степень окисления +3.
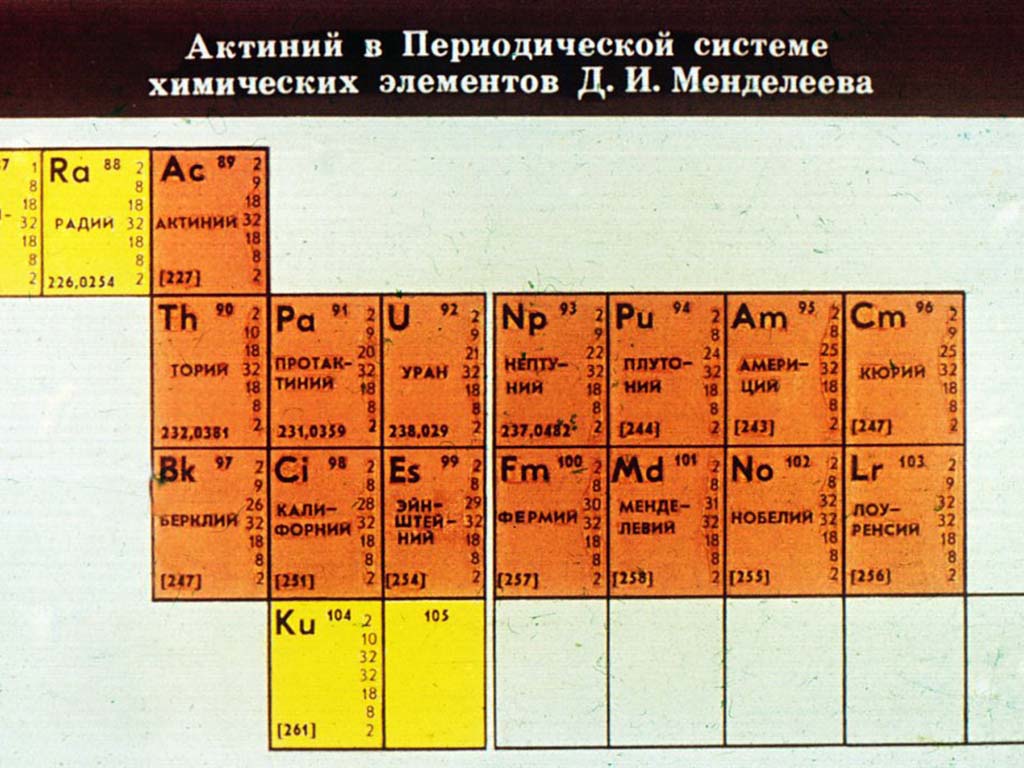
Седьмой период также содержит 32 элемента — от франция (Fr) до оганесона (Og). Период начинается с s-элементов (Fr и Ra), затем следуют 14 актиноидов (Ac — No). Эти элементы также вынесены в отдельный ряд внизу таблицы из-за близости их свойств, хотя они выражены меньше, чем у лантаноидов. Затем следуют десять 6d-элементов и шесть 6р-элементов. Все элементы этого периода являются радиоактивными, и большая их часть получена искусственным путём.
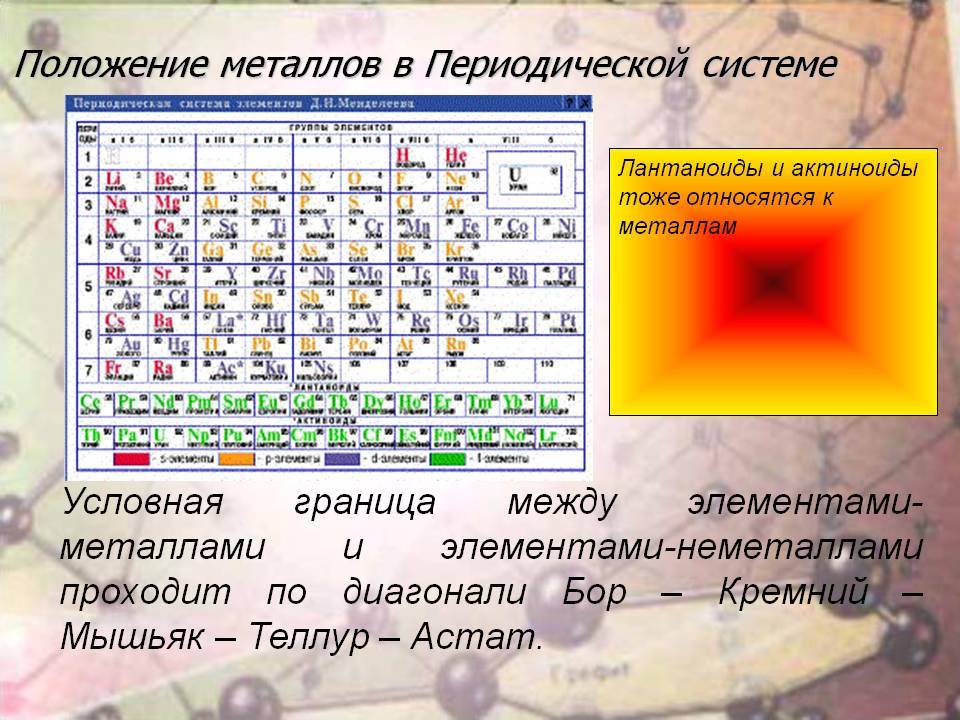
В периодической системе элементы разделены на группы. Две группы IA и IIA заполняют s-элементы. Далее располагаются десять В-групп, заполненных d-элементами. Завершают таблицу шесть А-групп, содержащих р-элементы.
Может ли быть открыто ещё больше химических элементов, чем известно сейчас? Ведь самые последние из известных элементов были открыты совсем недавно.
На этот вопрос отвечает теория ядерной физики. Пока с надёжностью предсказывают возможность существования химических элементов с порядковыми номерами до 126. В то же время есть научные концепции, которые предполагают искусственное получение химических элементов с порядковыми номерами до 173 с «островком стабильности» в области 164-го элемента.
У периодического закона нет привычного для физических законов математического выражения. Все попытки вывести математическую формулу периодического закона, предпринимавшиеся неоднократно, оказались безуспешными. В этом особенность свойств химических элементов и их соединений. Присущие им свойства не укладываются в простые математические выражения.
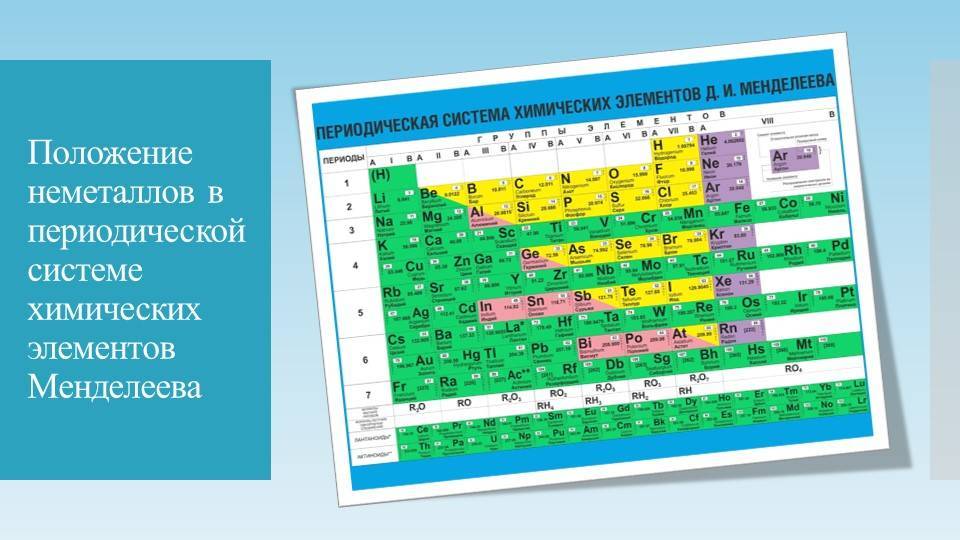
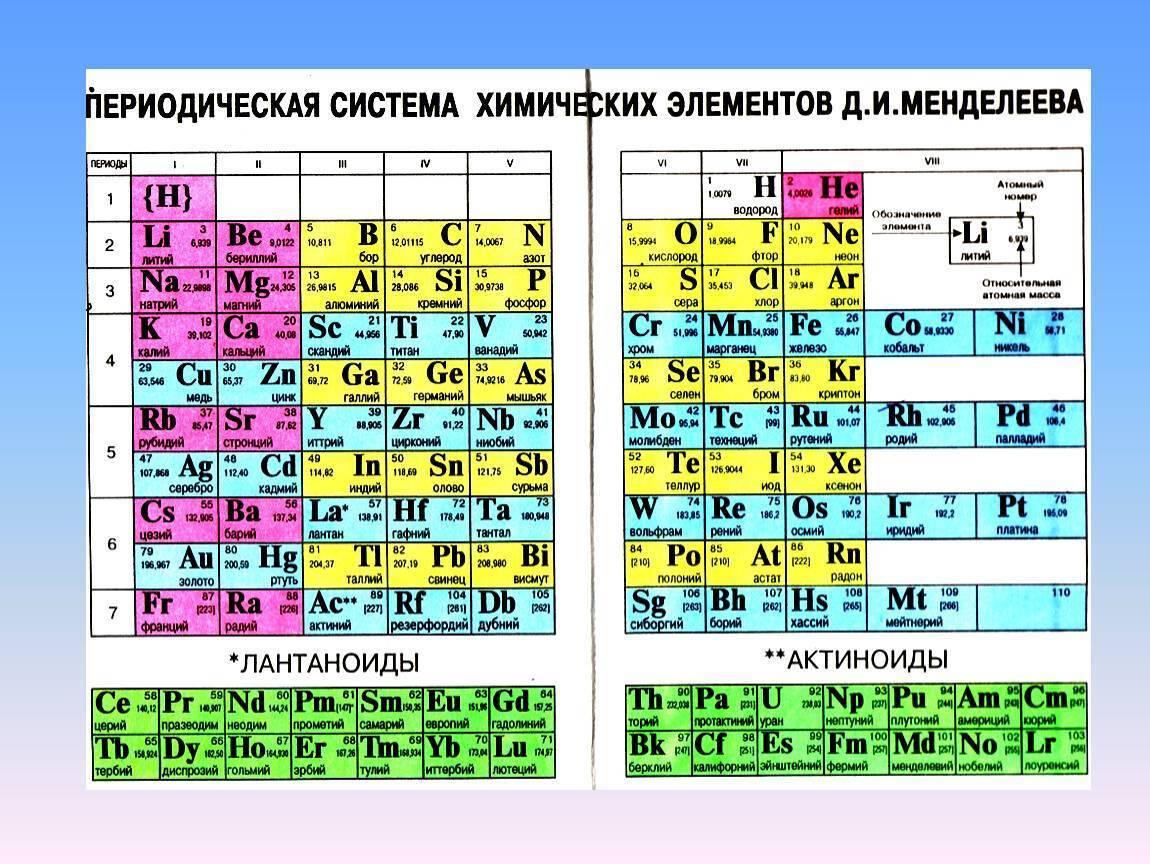
Своеобразной графической формой, выражающей периодический закон, стала периодическая система, которую Д. И. Менделеев представил в виде таблицы. По предложению ИЮПАК её так и называют: «Периодическая таблица элементов» (Periodic Table of the Elements), а у нас часто кратко: «Таблица Менделеева».
Таблица периодической системы — это иллюстрация закономерного расположения химических элементов относительно друг друга в периодической системе.
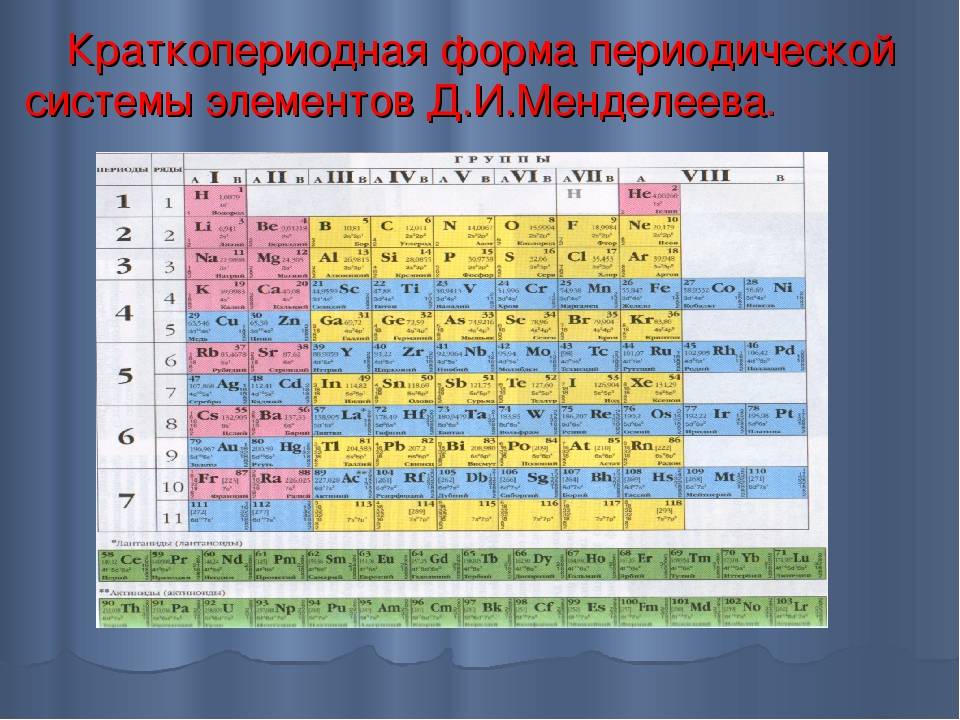
Менделеев посчитал более приемлемым представить периодическую систему в короткопериодной форме, которая в современном виде изображена на рисунке 20.1. В ней группы элементов подразделяются на подгруппы — главные и побочные. В главных подгруппах размещены s– и p-элементы, в побочных — d-элементы.
Рис. 20.1. Современный вариант короткопериодной периодической системы химических элементов
Позже ИЮПАК предложил использовать полудлиннопериодный вариант таблицы, в котором главные и побочные подгруппы были преобразованы в отдельные А- и В-группы: главные — в А-группы, побочные — в В-группы. Таких групп оказалось 18. Эта таблица изображена на форзаце учебника.
Существует вариант длиннопериодной таблицы, в которой f-элементы встроены в ряд с d-элементами (рис. 20.2). Существуют и другие варианты изображения периодической системы, их насчитывается около 500.
Рис. 20.2. Длиннопериодная форма периодической системы химических элементов
Атом и молекула лантана. Формула лантана. Строение атома лантана:
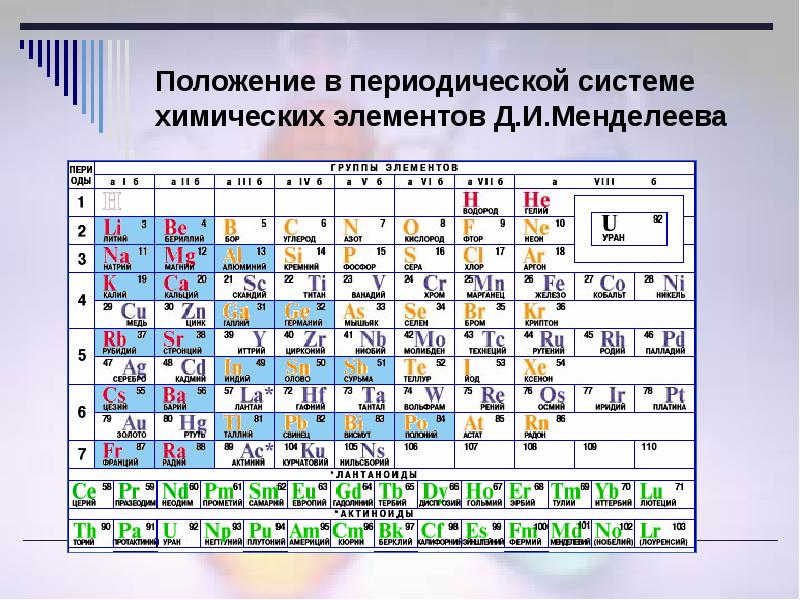
Лантан (лат. Lanthanum, от др.-греч. λανθάνω – «скрываюсь», «таюсь») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением La и атомным номером 57. Расположен в 3-й группе (по старой классификации – побочной подгруппе третьей группы), шестом периоде периодической системы.
Лантан – металл. Относится к редкоземельным элементам, а также к группе переходных металлов и к лантаноидам.
Как простое вещество лантан при нормальных условиях представляет собой мягкий, ковкий, вязкий, блестящий металл серебристо-белого цвета.
Молекула лантана одноатомна.
Химическая формула лантана La.
Электронная конфигурация атома лантана 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 5d1 6s2 или 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f 5s2 5p6 5d1 6s2. Потенциал ионизации (первый электрон) атома лантана равен 538,09 кДж/моль (5,5769(6) эВ).
Строение атома лантана. Атом лантана состоит из положительно заряженного ядра (+57), вокруг которого по шести оболочкам движутся 57 электронов. При этом 55 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку лантан расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья, четвертая и пятая – внутренние оболочки представлены s-, р- и d-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома лантана на 5d-орбитали находится один неспаренный электрон. На внешнем энергетическом уровне атома лантана на 6s-орбитали находятся два спаренных электрона. В свою очередь ядро атома лантана состоит из 57 протонов и 82 нейтронов. Лантан относится к элементам f-семейства.
Радиус атома лантана (вычисленный) составляет: нет данных. Эмпирический радиус атома лантана составляет 195 пм.
Атомная масса атома лантана составляет 138,90547(7) а. е. м.
Лантан вместе с церием и неодимом относится к наиболее распространенным редкоземельным элементам. Содержание лантана в земной коре составляет 0,0034 %, в морской воде и океане – 3,4×10–10 %.
Сокращение лантаноидов
→ Основная статья : Сокращение лантаноидов
Из-за сжатия лантаноидов атомный радиус почти непрерывно уменьшается в диапазоне от церия (183 мкм) до лютеция (172 мкм) (исключение составляют европий и иттербий). Это связано с тем, что элементы, которые – в зависимости от атомного номера – находятся перед лантаноидами, уже заполнили электронами оболочки 6s и 5p, но не оболочку 4f. Теперь лантаноиды заполняют 4f-оболочку электронами. В упрощенном представлении атома как состоящего из пространственно разделенных электронных оболочек, электронная оболочка, пространственно более близкая к ядру, теперь заполнена носителями заряда. Вдобавок ядро, конечно, заполнено тем же числом протонов, что и электроны, добавленные к 4f-оболочке. В результате более сильное притяжение между электронами и протонами сокращает атомный радиус, в то время как атомный номер увеличивается.
Этот эффект на самом деле не является исключительным, поскольку радиус всегда уменьшается, когда чаша наполняется в течение определенного периода времени. Однако это свойство имеет некоторые последствия:
- Благодаря уменьшающимся размерам легко возможно разделение с помощью ионообменников .
- В гольмии радиус Ln 3+ настолько мал, что почти соответствует радиусу Y 3+ ; поэтому иттрий обычно встречается вместе с «тяжелыми землями».
- Внутри группы переходные элементы во 2-й и 3-й позициях имеют очень похожие свойства.
Распространение в природе
Оксиды актиноидов и лантаноидов часто называют циркониевой, ториевой, иттриевой землями. Они являются основным источником для получения соответствующих металлов. Уран, как главный представитель актиноидов, находится в наружном слое литосферы в форме четырёх видов руд или минералов. Прежде всего, это урановая смолка, представляющая собой двуокись урана. В ней содержание металла самое высокое. Часто диоксиду урана сопутствуют радиевые месторождения (жилы). Они встречаются в Канаде, Франции, Заире. Комплексы ториевой и урановой руды часто содержат руды других ценных металлов, например золота или серебра.
Запасами такого сырья богаты Россия, Южно-Африканская республика, Канада и Австралия. В некоторых осадочных породах содержится минерал карнотит. В его состав, кроме урана, входит еще и ванадий. Четвертый вид уранового сырья – это фосфатные руды и железоурановые сланцы. Их запасы находятся в Марокко, Швеции и США. В настоящее время перспективными считаются также залежи лигнитов и каменного угля, содержащие примеси урана. Их добывают в Испании, Чехии, а также в двух американских штатах – Северной и Южной Дакоте.
Разница между лантаноидами и актиноидами – Разница Между
Лантан без лантаноидов
Как ни грустно сознавать, герой нашего рассказа — личность вполне заурядная. Это металл, обыкновенный по внешнему виду (серебристо-белый, покрытый сероватой окисной пленкой) и по физическим свойствам: температура плавления 920, кипения 3469° С; по прочности, твердости, электропроводности и прочим характеристикам металл лантан всегда оказывается в середине таблиц. Обыкновенен лантан и по химическим свойствам. В сухом воздухе он не изменяется — окисная пленка надежно защищает от окисления в массе. Но если воздух влажен (а в обычных земных условиях он влажен почти всегда), металлический лантан постепенно окисляется до гидроокиси. La(OH)3 — основание средней силы, что опять-таки характерно для металла-«середнячка».
церий
Новый элемент, обнаруженный в церите и мозандерите, по предложению Берцелиуса назвали лантаном. Название с намеком: оно происходит от греческого A,av0dveiv — скрываться, забываться. Лантан, содержащийся в церите, успешно скрывался от химиков в течение 36 лет! Долгое время считали, что лантан двухвалентен, что он аналог кальция и других щелочноземельных металлов, а его атомный вес равен 90—94. В правильности этих цифр не сомневались до 1869 г. Менделеев же увидел, что во II группе периодической системы редкоземельным элементам нет места и поставил их в III группу, приписав лантану атомный вес 138—139. Но правомерность такого перемещения еще надо было доказать. Менделеев предпринял исследование теплоемкости лантана. Полученная им величина прямо указывала на то, что этот элемент должен быть трехвалентным… Металлический лантан, разумеется, далеко не чистый, впервые был получен Мозандером при нагревании хлористого лантана с калием. В наше время в промышленных масштабах получают лантан чистотой более 99%. Проследим, как это делается, но прежде познакомимся с главными минералами лантана и первыми стадиями сложнейшего процесса разделения редкоземельных элементов. Уже упоминалось, что в минералах лантан и лантаноиды неизменно сопутствуют друг другу. Есть минералы селективные, в которых доля того или иного редкоземельного элемента больше, чем обычно. Но нет минералов чисто лантановых или чисто цериевых, не говоря уже о других лантаноидах. Примером селективного лантанового минерала может служить давидит, в котором до 8,3% Lа203 и лишь 1,3% окиси церия. Но получают лантан преимущественно из монацита и бастнезита, как, впрочем, и церий, и все остальные элементы цериевой подгруппы. Монацит — тяжелый блестящий минерал, обычно желто-бурый, но иногда и других цветов, поскольку постоянством состава он не отличается. Точнее всего его состав описывает такая странная формула: (РЗЭ)Р04. Она означает, что монацит — фосфат редкоземельных элементов (РЗЭ). Обычно в монаците 50—68% окислов РЗЭ и 22—31,5% Ра05. А еще в нем до 7% двуокиси циркония, 10% (в среднем) двуокиси тория и 0,1—0,3% урана. Эти цифры со всей очевидностью показывают, почему так тесно переплелись пути редкоземельной и атомной промышленности. Смешанный металл редких земель — мишметалл — и смесь их окислов начали применять в конце прошлого века, а в начале нынешнего в связи с ними был /продемонстрирован выдающийся образец международного воровства. Немецкие суда, доставлявшие грузы в Бразилию, собираясь в обратный путь, заполняли трюмы песком с пляжей Атлантического побережья этой страны, причем из определенных мест. Капитаны заявляли, что песок — это просто балласт, необходимый для большей устойчивости судна. В действительности же они, выполняя заказы германских промышленников, крали ценное минеральное сырье — прибрежные пески штата Эспириту-Санту, богатые монацитом… Монацитовые россыпи распространены по берегам рек, озер и морей на всех континентах. В начале века (данные за 1909 г.) 92% мировой добычи редкоземельного сырья, и прежде всего монацита, приходилось на долю Бразилии. Спустя десять лет центр тяжести переместился на тысячи километров к востоку (или к западу, смотря как считать) — в Индию. После 1950 г. в связи с развитием атомной промышленности гегемоном среди капиталистических стран в добыче и переработке редкоземельного сырья стали Соединенные Штаты.
циркона432Кадмий3празеодима
К 1965 г. внешнеторговые организации нашей страны могли предложить покупателям все лантаноиды в виде металлов чистотой выше 99%. Кроме прометия, разумеется, хотя радиоактивные препараты этого элемента — продукты ядерного распада урана — тоже стали вполне доступны. В каталоги «Техснабэкспорта» вошли также около 300 химически чистых и особо чистых соединений лантана и лантаноидов. Это свидетельство высокого уровня развития советской редкоземельной промышленности. Но вернемся к лантану.
Характерные химические реакции (adsbygoogle = window.adsbygoogle || []).push({});
Как было отмечено ранее, лантаноиды и актиноиды являются химически активными металлами. Так, лантан, церий и другие элементы семейства легко соединяются с простыми веществами – галогенами, а также с фосфором, углеродом. Лантаноиды могут также взаимодействовать как с монооксидом углерода, так и с углекислым газом. Они также способны разлагать воду. Кроме простых солей, например таких как SeCl3 или PrF3, они образуют двойные соли
В аналитической химии важное место занимают реакции металлов-лантаноидов с аминоуксусной и лимонной кислотами. Образующиеся в результате таких процессов комплексные соединения применяются для разделения смеси лантаноидов, например в рудах. При взаимодействии с нитратной, хлоридной и сульфатной кислотами, металлы образуют соответствующие соли
Они хорошо растворимы в воде и легко способны к образованию кристаллогидратов. Нужно отметить, что водные растворы солей лантаноидов окрашены, что объясняется присутствием в них соответствующих ионов. Растворы солей самария или празеодима зеленого цвета, неодима – красно-фиолетового, прометия и европия – розового. Так как ионы со степенью окисления +3 окрашены, это используется в аналитической химии для распознавания ионов металлов-лантаноидов (так называемые качественные реакции). Для этой же цели применяют еще и такие методы химического анализа, как дробная кристаллизация и ионообменная хроматография
При взаимодействии с нитратной, хлоридной и сульфатной кислотами, металлы образуют соответствующие соли. Они хорошо растворимы в воде и легко способны к образованию кристаллогидратов. Нужно отметить, что водные растворы солей лантаноидов окрашены, что объясняется присутствием в них соответствующих ионов. Растворы солей самария или празеодима зеленого цвета, неодима – красно-фиолетового, прометия и европия – розового. Так как ионы со степенью окисления +3 окрашены, это используется в аналитической химии для распознавания ионов металлов-лантаноидов (так называемые качественные реакции). Для этой же цели применяют еще и такие методы химического анализа, как дробная кристаллизация и ионообменная хроматография.
У актиноидов можно выделить две группы элементов. Это берклий, фермий, менделевий, нобелий, лоуренсий и уран, нептуний, плутоний, омереций. Химические свойства первой из них подобны лантану и металлам из его семейства. Элементы второй группы обладают очень похожими химическими характеристиками (практически идентичны друг другу). Все актиноиды быстро взаимодействуют с неметаллами: серой, азотом, углеродом. С кислородсодержащими легандами они образуют комплексные соединения. Как видим, металлы обоих семейств близки между собой по химическому поведению. Вот почему лантаноиды и актиноиды часто называют металлами-близнецами.