Молекулярно-кинетическая теория
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно изучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом.
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости.
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другие положения, то мы имеем дело с твердым веществом.
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 оС она замерзает – переходит из жидкого состояния в твердое, и при 100 оС закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.

Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.

Пластичность – это способность вещества деформироваться без разрушения.

Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.
В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным. Примеры аморфных веществ – уголь, слюдяное стекло.

Аморфный бор
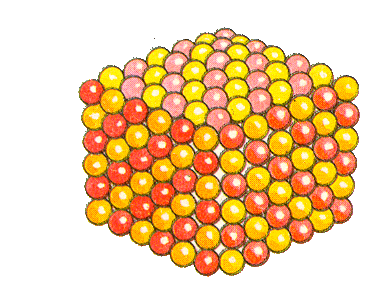
Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом, а саму структуру – кристаллической решеткой. Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку, различают атомную, молекулярную, ионную и металлическую кристаллическую структуру.
Кристаллическое строение металлов
Определение 1
Металлы – это группа элементов периодической таблицы Менделеева, которые являются восстановителями с положительной степенью окисления, обладают твердостью, пластичностью и упругостью, обусловленными их кристаллическим строением.
Кристаллические решетки металлов представляют собой атомы, упорядоченные определенным образом. В состав каждого атома входят несколько отрицательно заряженных электронов и положительно заряженное ядро. Атомы металлов мало электронов, поэтому они являются ионами. Единица кристаллической решетки представляет собой элементарную кристаллическую ячейку, в гранях и узлах которой находятся ионы. Вместе их удерживают металлические связи, которые возникают в результате беспорядочного движения отделившихся от атомов электронов. Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны.
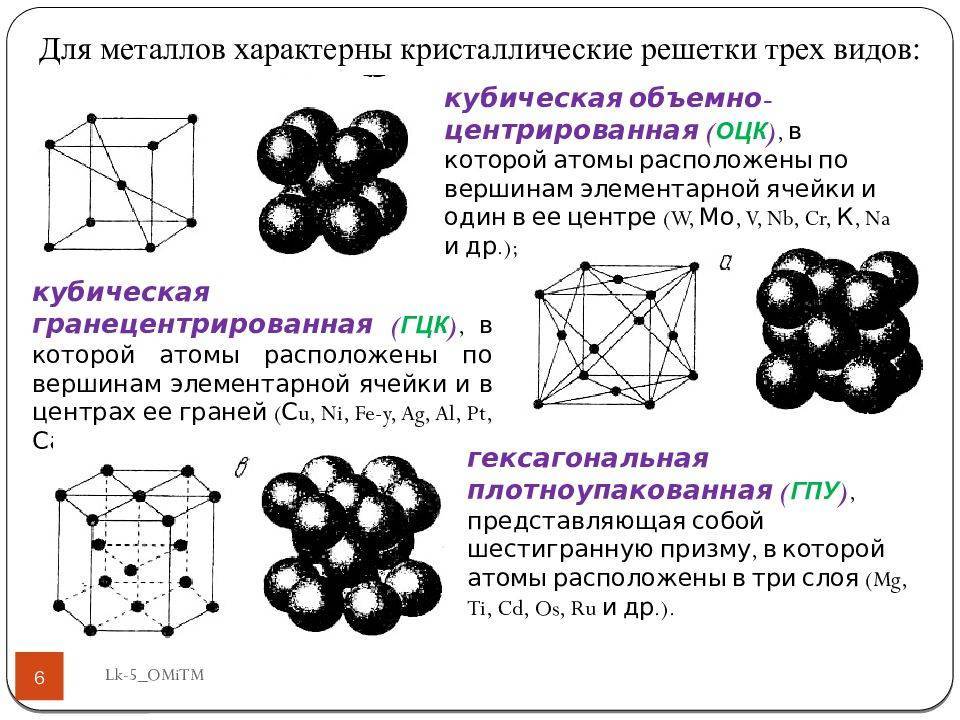
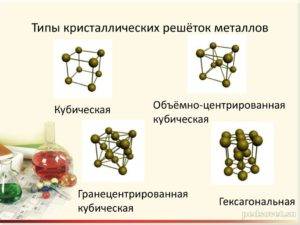
Подавляющему большинству металлов свойственно образование высокосимметричных кристаллических решеток с плотной упаковкой атомов. Самыми распространенными типами кристаллических решеток атомов являются:
- Объемно-центрированная кубическая кристаллическая решетка, которая представляет собой куб с дополнительными атомами, которые находятся в центре. Такая решетка имеется у железа, хрома, вольфрама, молибдена и ванадия.
- Гранецентрированная кубическая кристаллическая решетка, которая представляет собой куб с дополнительными атомами, находящиеся центре каждой грани. Такая решетка имеется у железа, алюминия, меди, никеля, а также золота.
- Гексагональная плотноупакованная кристаллическая решетка с шестиугольниками в нижнем и верхнем основаниях, которые образованы расположенными там атомами, а также одним атомом в центре каждого шестиугольника. Внутри каждой фигуры находится три атома. Такая решетка имеется у кадмия, цинка, магния и других металлов.
- Тетрагональная кристаллическая решетка получается в результате растягивания куба вдоль одной оси. Данный тип решетки может быть гранецентрированным и объемноцентрированным. Такую решетку имеют радий и индий.
У некоторых видов металлов кристаллическая решетка изменяется в результате изменения температуры. Данное явления называется аллотропией или полиморфизм. Такое явления может быть причиной изменения свойств металла, а характерно оно для цинка, железа, олова и циркония.
Виды кристаллических решеток металлов
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место.
Подтверждение этому: и в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества: и в археологических находках металлических изделий (кованые медные украшения, сельскохозяйственные орудия); и в повсеместном использовании металлов и сплавов в современной технике. Причина этого — в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Материаловедение. Металловедение.
Металлы – один из классов конструкционных материалов, характеризующийся определенным набором свойств:
- «металлический блеск» (хорошая отражательная способность);
- пластичность;
- высокая теплопроводность;
- высокая электропроводность.
Строение металлов. Атомно-кристаллическое строение металлов
Данные свойства обусловлены особенностями строения металлов.
Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны.
На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объему металла, т.е. принадлежать целой совокупности атомов.
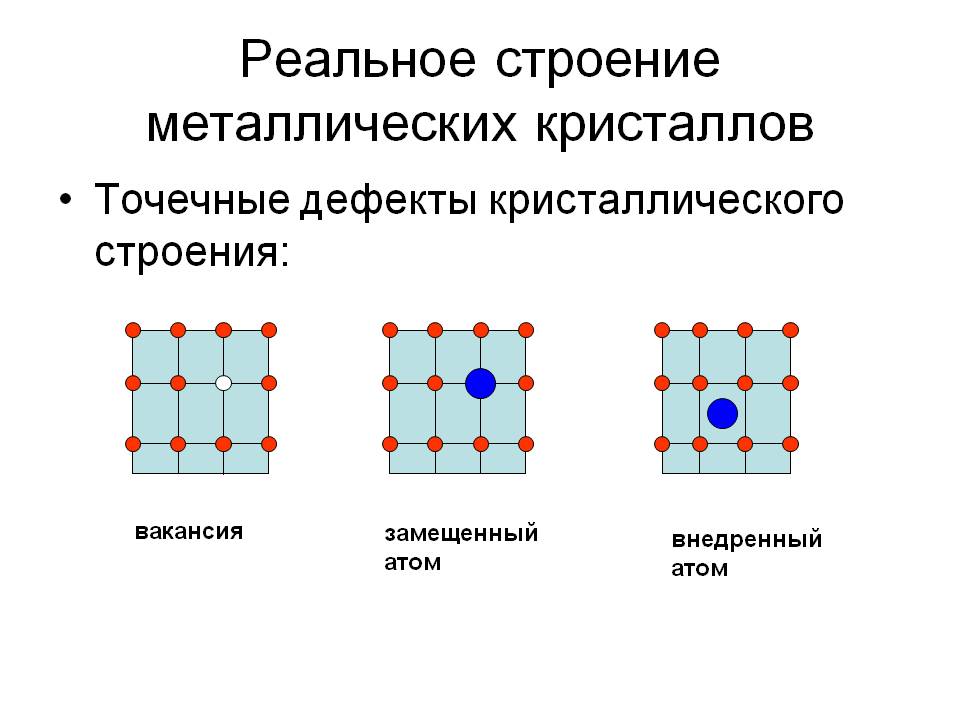
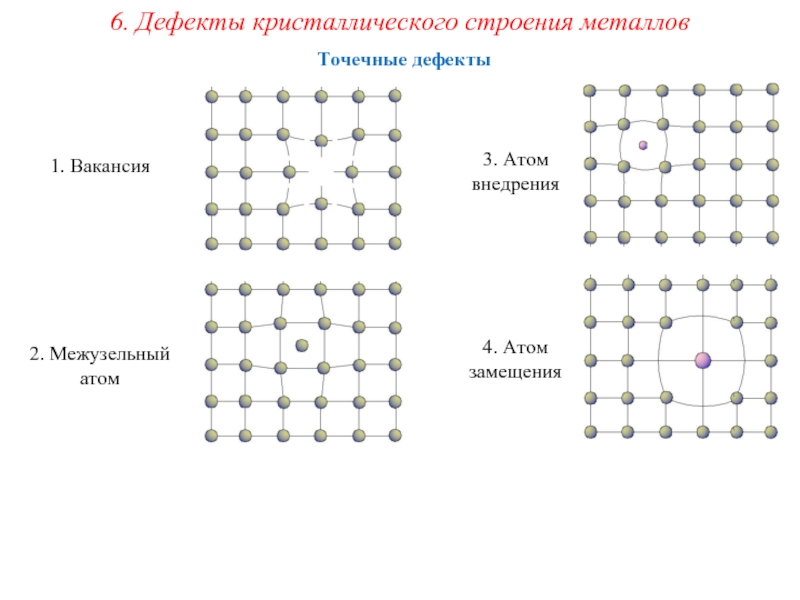
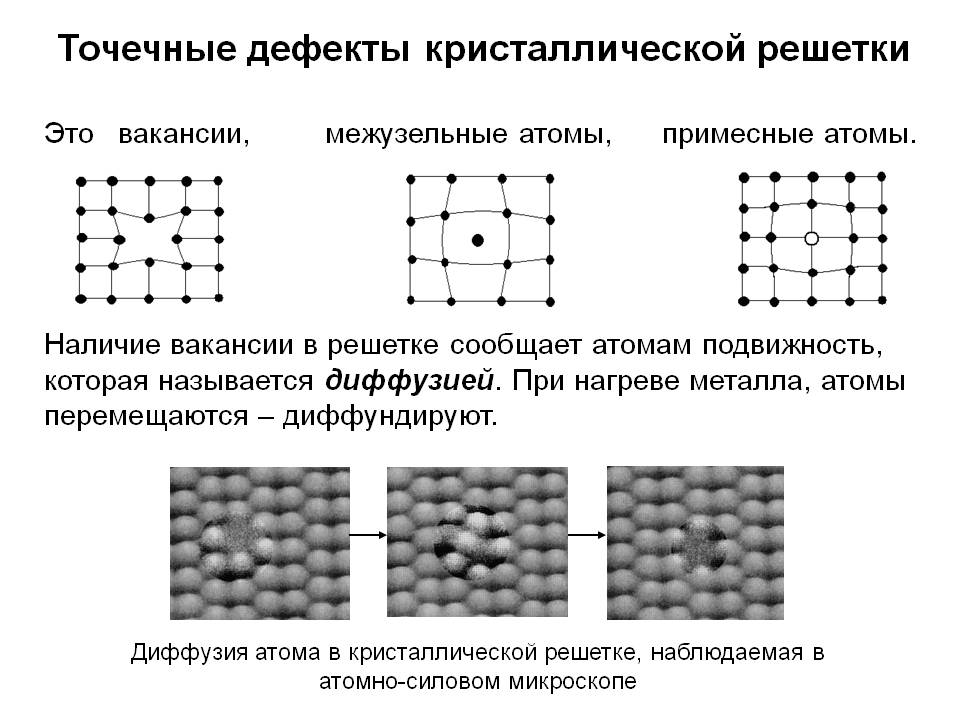
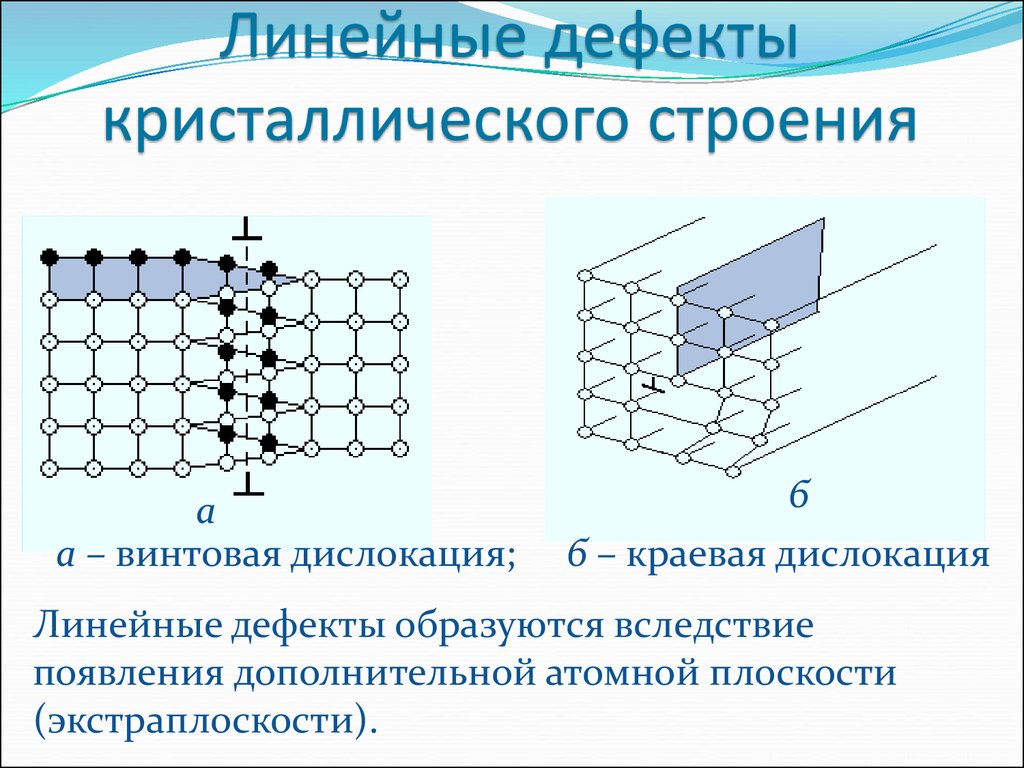
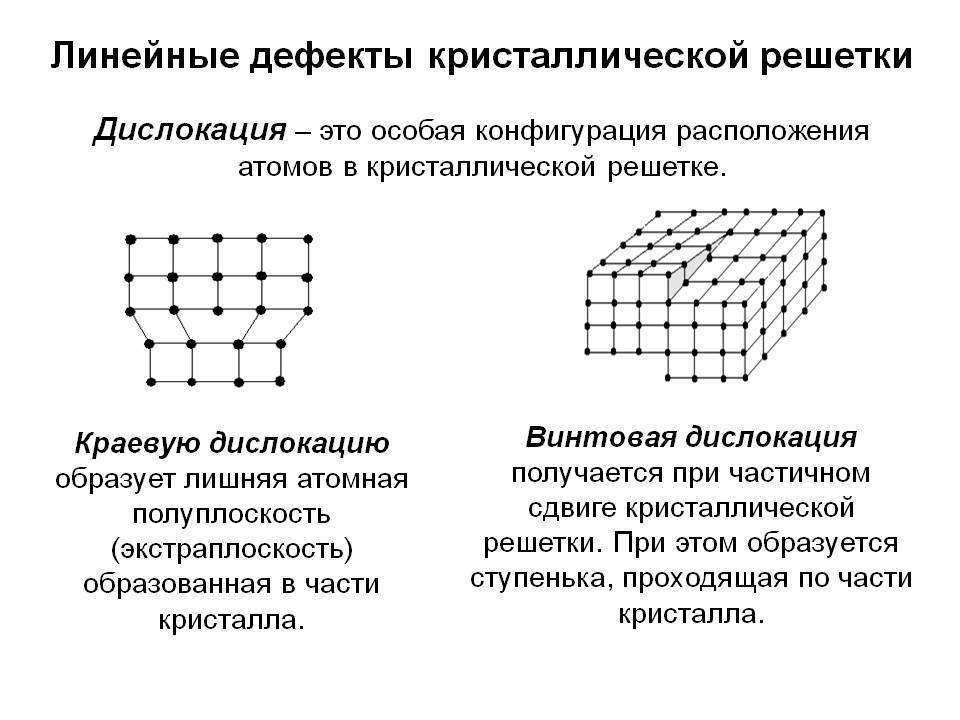
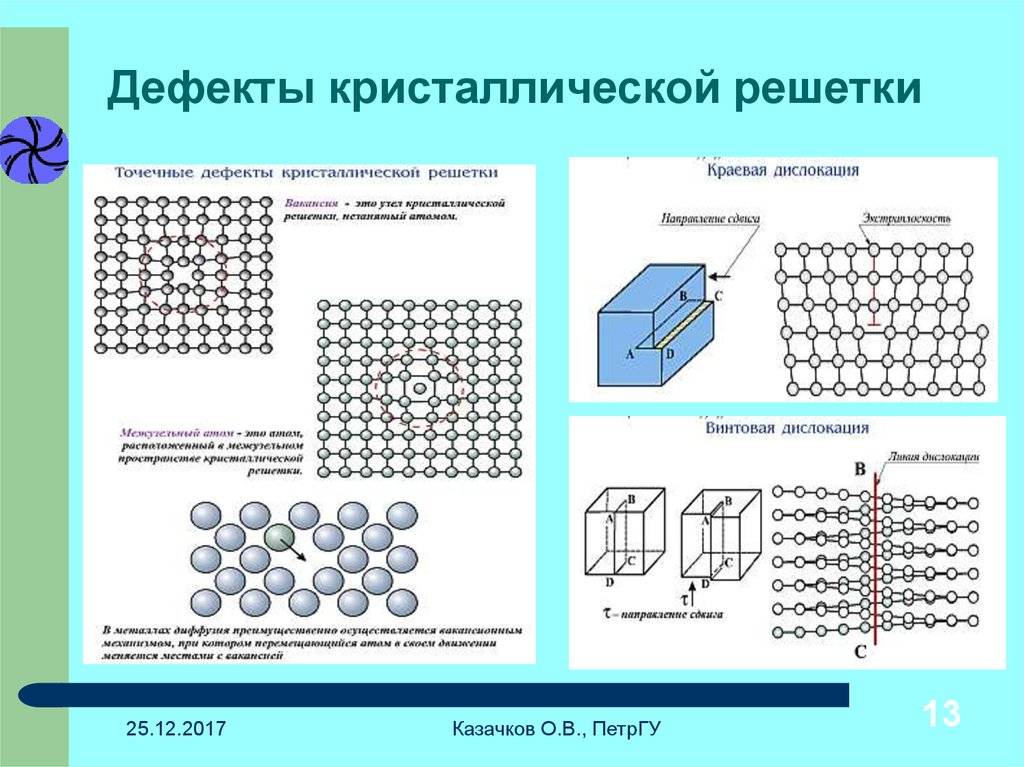
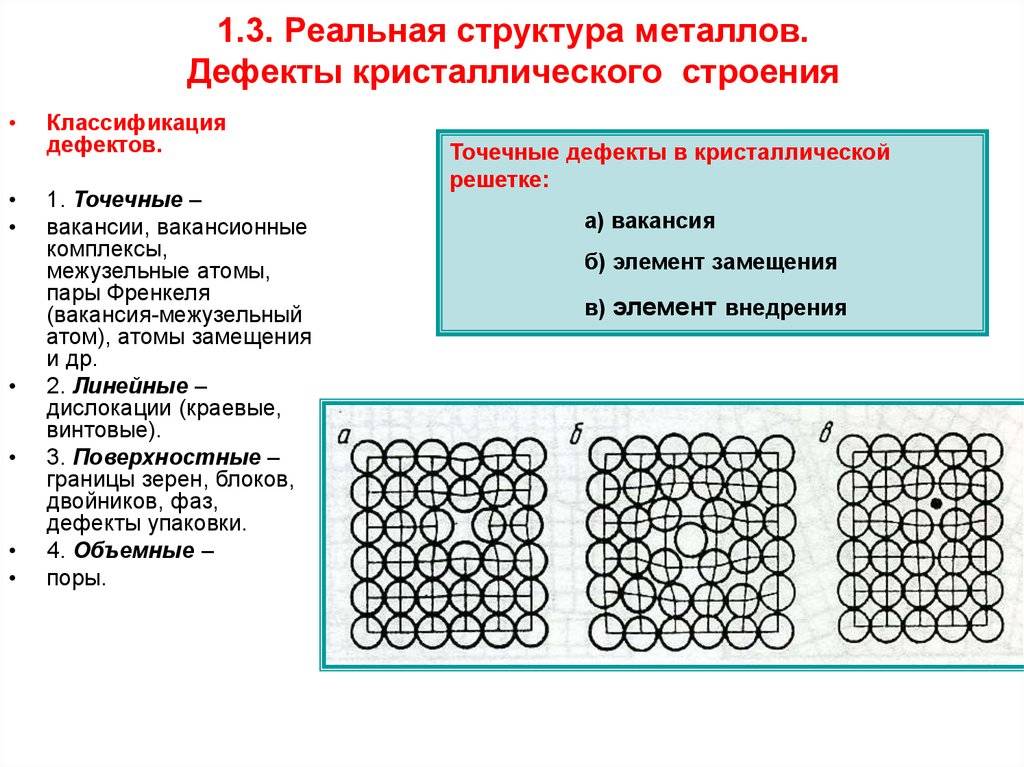
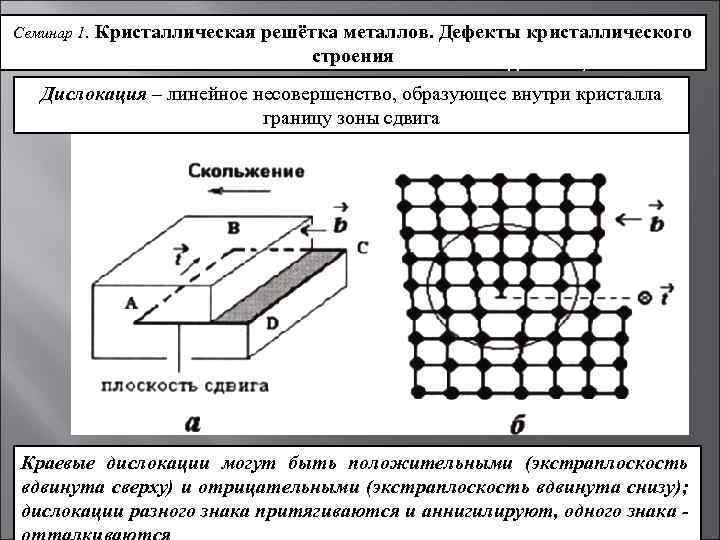
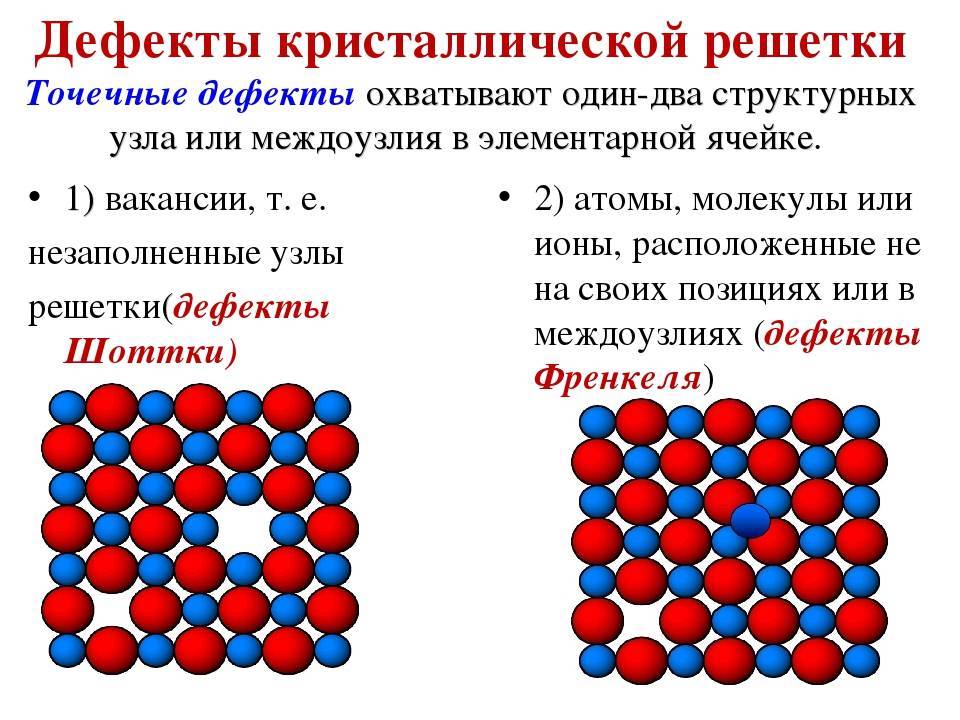
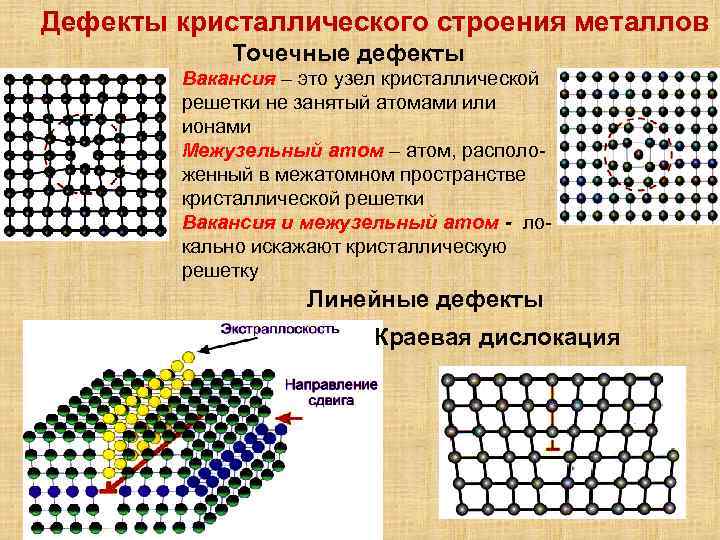
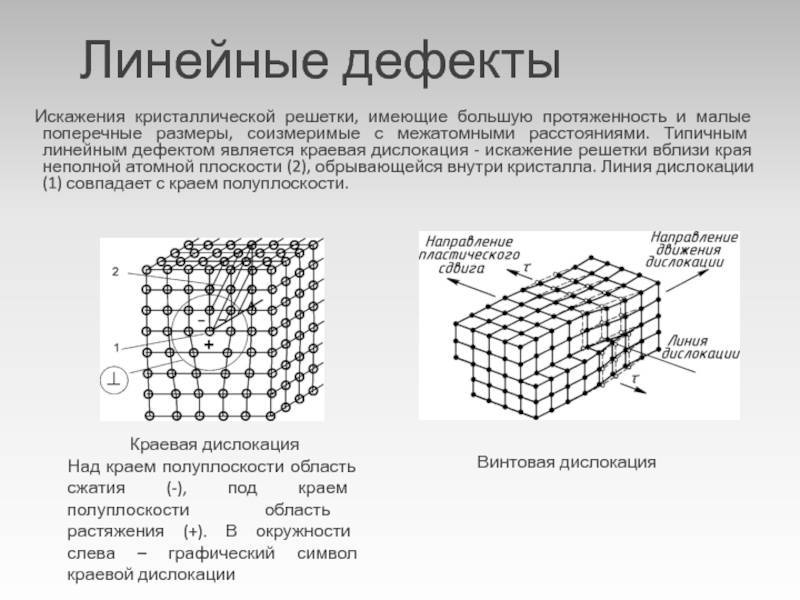
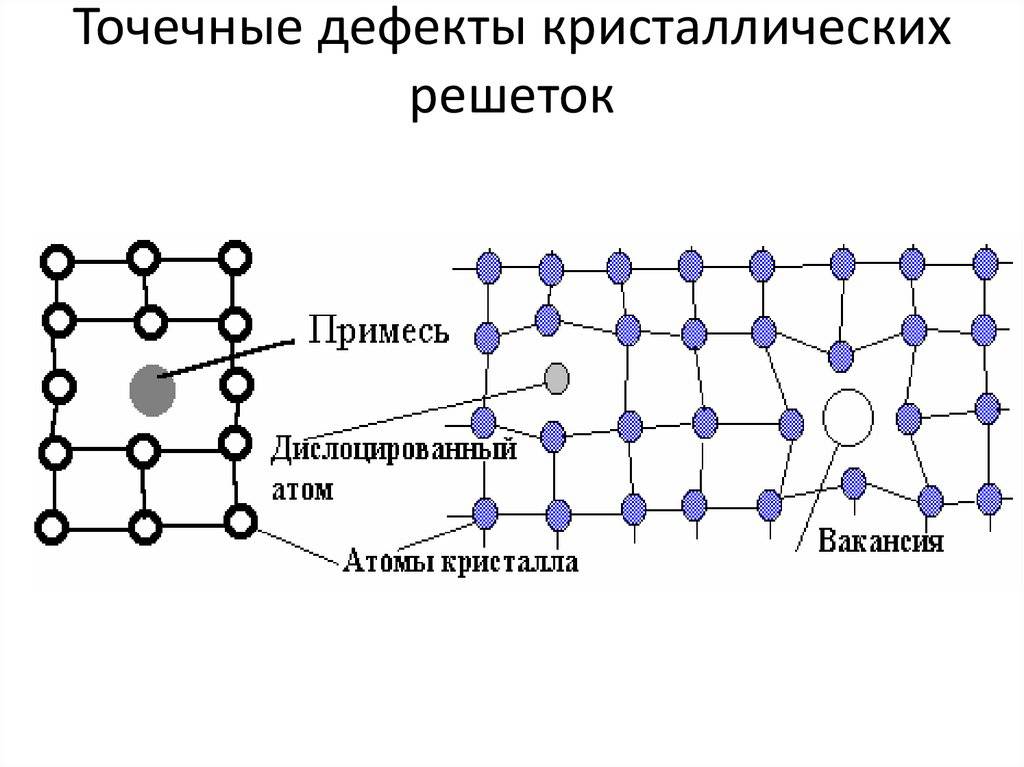
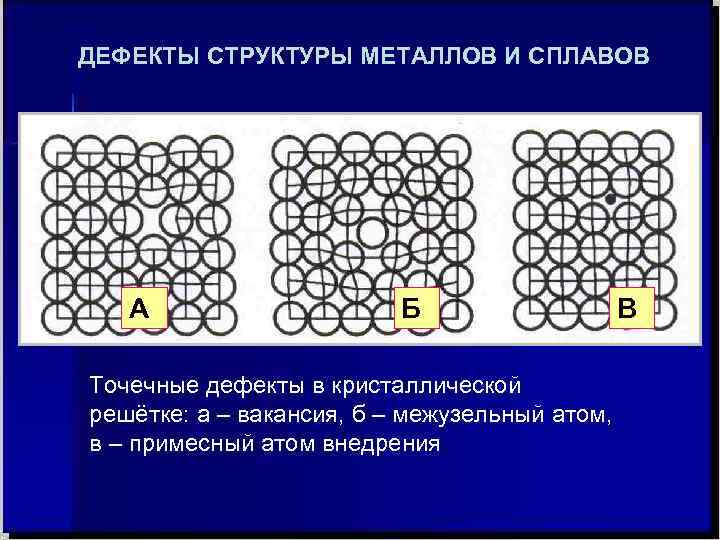
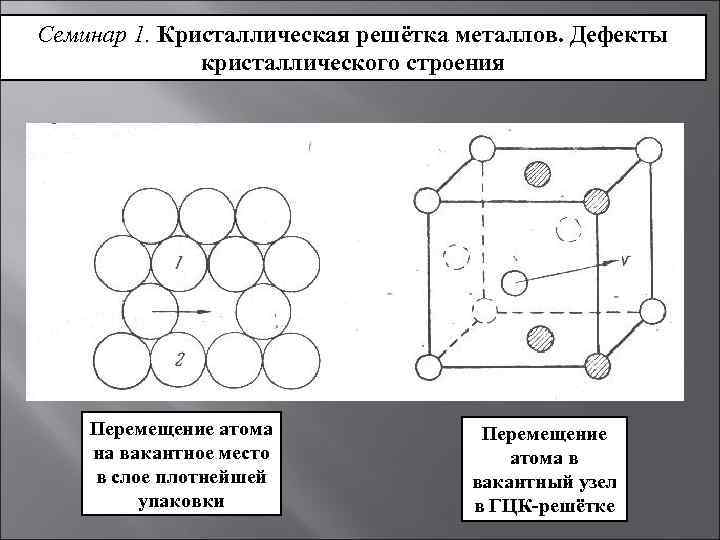
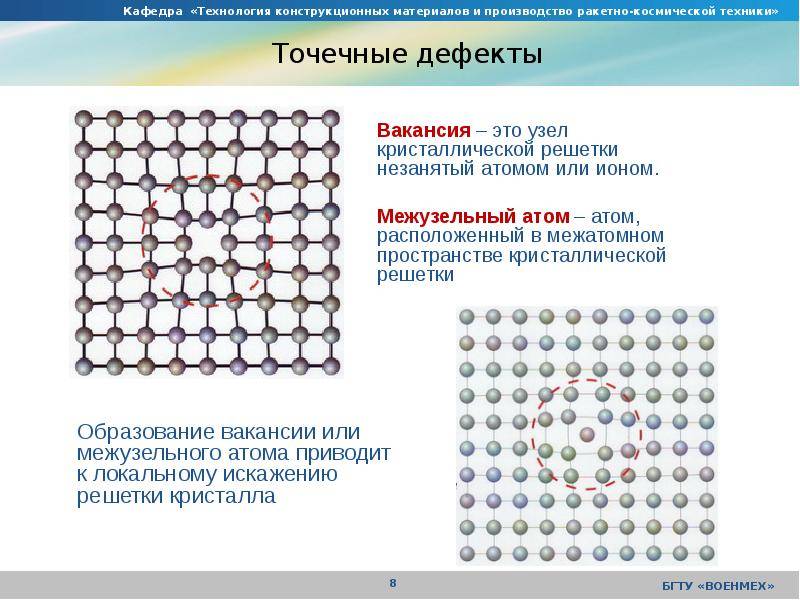
Дефекты кристаллического строения. Точечные дефекты.Аллотропия. Полиморфные превращения. Магнитные превращения.
Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
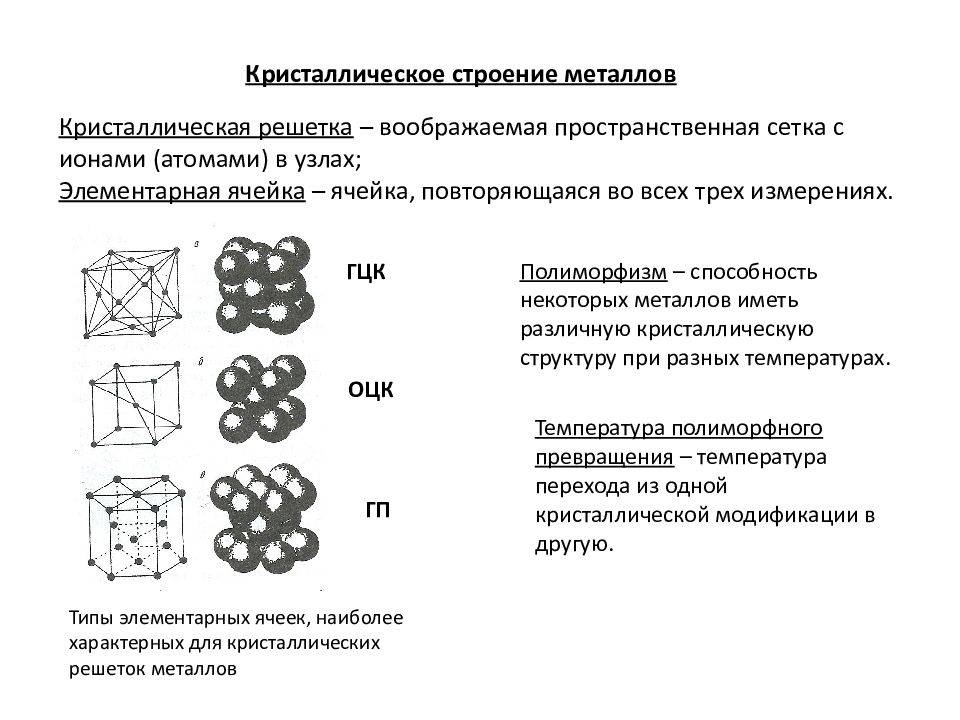
Кристаллическая решетка металлов
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка. Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл. Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
- размеры ребер элементарной ячейки. a, b, c – периоды решетки – расстояния между центрами ближайших атомов (в одном направлении выдерживаются строго определенными);
- углы между осями (α, β, χ);
- координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке;
- базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки;
- плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74).
Схема кристаллической решетки
Рис. 1
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа:
- примитивный – узлы решетки совпадают с вершинами элементарных ячеек;
- базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
- объемно-центрированный – атомы занимают вершины ячеек и ее центр;
- гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней.
Ионная кристаллическая решетка
Как известно, при ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
твердость;
хрупкость;
тугоплавкость;
нелетучесть;
электропроводность;
способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.

Основные группы металлов в промышленности
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.

Черные металлы
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.

Легкие цветные металлы
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
Медь Олово Цинк Свинец Чистый никель
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.
 Золото и платина
Золото и платина
 Серебро
Серебро
На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.
 Иттрий
Иттрий
 Сканидий
Сканидий
 Лантан
Лантан
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.

Щелочные металлы
https://youtube.com/watch?v=01JxRXVDSvc
Периодическая таблица и металлы

В XIX веке благодаря своему блестящему уму и многим годам труда Дмитрий Иванович Менделеев составил таблицу, собрав в нее все известные на то время химические элементы. Каждому из них в таблице отведено определенное положение в соответствии с числом протонов в атомном ядре. Вся таблица делится на 7 периодов (горизонтальные строки) и 8 групп (вертикальные строки). Чем больше период, тем больше радиус атома соответствующего элемента, и тем на более высоких орбиталях расположены его валентные электроны. Наоборот, чем старше группа (движение по таблице слева направо), тем больше валентных электронов находится на последней орбитали и тем меньше радиус атома.
Любой элемент таблицы можно условно отнести либо к металлам, либо к неметаллам. Металлы расположены по левую сторону от диагонали бор (B) – полоний (Po). Если взглянуть на таблицу, то можно сразу понять, что количество металлов в несколько раз превышает число неметаллов.
Читать также: Торцовочная пила с протяжкой калибр
Добыча золота
Сегодня основным добытчиком золота является государство, которое добывает металл промышленным методом. В России первый самородок, а в последствии и рудник был найден в 1745 году. Сегодня добычей золота в России занимаются 16 компаний. Добыча ведется на территории Чукотки, Магаданской области, в Амурской и Иркутской области, в Хабаровском и Красноярском крае, в Челябинске.

Так процесс золотодобычи сложный и дорогостоящий, специалисты постоянно работают над его удешевлением. Наиболее распространенный способ – закрытие нерентабельных мест добычи.
За все время человечеством добыто около 170 тонн драгоценного металла.
Физические свойства
Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
Для железа характерен полиморфизм, он имеет четыре кристаллические модификации:
- до 769 °C существует α-Fe (феррит) с объёмноцентрированной кубической решёткой и свойствами ферромагнетика (769 °C ≈ 1043 — точка Кюри для железа)
- в температурном интервале 769—917 °C существует β-Fe, который отличается от α-Fe только параметрами объёмноцентрированной кубической решётки и магнитными свойствами парамагнетика
- в температурном интервале 917—1394 °C существует γ-Fe (аустенит) с гранецентрированной кубической решёткой
- выше 1394 °C устойчив δ-Fe с объёмоцентрированной кубической решёткой
Металловедение не выделяет β-Fe как отдельную фазу, и рассматривает её как разновидность α-Fe. При нагреве железа или стали выше точки Кюри (769 °C ≈ 1043 ) тепловое движение ионов расстраивает ориентацию спиновых магнитных моментов электронов, ферромагнетик становится парамагнетиком — происходит фазовый переход второго рода, но фазового перехода первого рода с изменением основных физических параметров кристаллов не происходит.
Для чистого железа при нормальном давлении, с точки зрения металловедения, существуют следующие устойчивые модификации:
От абсолютного нуля до 910 °C устойчива α-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой. Твёрдый раствор углерода в α-железе называется ферритом.
От 910 до 1400 °C устойчива γ-модификация с гранецентрированной кубической (ГЦК) кристаллической решёткой. Твёрдый раствор углерода в γ-железе называется аустенитом.
От 910 до 1539 °C устойчива δ-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой. Твёрдый раствор углерода в δ-железе (также как и в α-железе) называется ферритом. Иногда различают высокотемпературный δ-феррит и низкотемпературный α-феррит (или просто феррит), хотя их атомные структуры одинаковы.
Наличие в стали углерода и легирующих элементов существенным образом изменяет температуры фазовых переходов (см. фазовую диаграмму железо — углерод).
В области высоких давлений (свыше 104 МПа, 100 тыс. атм.) возникает модификация ε-железа с гексагональной плотноупакованной (ГПУ) решёткой.
Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α—γ переходам кристаллической решётки происходит термообработка стали. Без этого явления железо как основа стали не получило бы такого широкого применения
Без этого явления железо как основа стали не получило бы такого широкого применения.
Железо тугоплавко, относится к металлам средней активности. Температура плавления железа 1539 °C, температура кипения — 2862 °C.
Почему стоит заказать решетки на окна именно у нас
Компания «Стальной декор» уже 10 лет создает прочные и красивые металлические решетки для окон и устанавливает их в домах и офисах на всей территории Москвы и Московской области. Репутация для нас — это не просто слово. Мы настолько уверены в качестве своих изделий, что назначаем гарантийный срок для каждой металлической конструкции до 5 лет. Отдельное изделие проходит несколько этапов отбраковки, но последнее слово всегда за клиентом!
Если Вы живете на первом этаже или в собственном доме, то наверняка перед Вами периодически возникает вопрос: какие решетки установить на окна? Это необходимый элемент, который позволит Вам защитить свое имущество и защитить в случае необходимости Вашу семью. Именно поэтому, к выбору оконных решеток стоит подходить очень ответственно! Сегодня мы расскажем Вам, как правильно выбрать решетки на окна. Кроме того, оконные решетки могут украсить и улучшить внешний вид Вашего дома или квартиры. Есть всего два основных вида решеток. Первый — это сварные решетки. В настоящее время ни пользуется популярностью именно этот вид решеток. Их преимущество в прочности и жесткости. Кроме того, цены на такие решетки ниже. Однако сварные решетки не отличаются особо привлекательным дизайном, поэтому не всем покупателям они нравятся.
Кованые решетки привлекают своим внешним видом. Они могут быть очень изящными и стильными. Однако стоимость таких решеток будет гораздо выше, поскольку каждая решетка делается индивидуально под заказ. Если у Вас есть финансы, то кованые решетки будут оптимальным вариантом. По конструкции решетки бывают: * из прутка с круглым или квадратным сечением (они наиболее крепкие, благодаря своей толщине от 12 до 20 мм); * из полосы с прямоугольным сечением (этот профиль обойдется вам дешевле, однако будет отличаться меньшей надежностью).
Если Вы решили делать решетки на заказ, обратите внимание на материал , из которого они будут изготовлены. Вы вполне можете заказать себе решетки на окна, изготовленные из сочетания двух конструкций
По типу монтажа решетки на окна мало чем различаются
Мастер лишь выбирает способ крепления, который зависит от особенностей изделия. Решетки могут быть стационарными, распашными, раздвижными или съемными. Все что Вам необходимо — это решить, какой вид решеток необходим в Вашем случае
По типу монтажа решетки на окна мало чем различаются. Мастер лишь выбирает способ крепления, который зависит от особенностей изделия. Решетки могут быть стационарными, распашными, раздвижными или съемными. Все что Вам необходимо — это решить, какой вид решеток необходим в Вашем случае.
Стационарные решетки крепятся раз и навсегда. Вы не сможете их открыть, и их конструкция максимально надежна. Процесс крепления: * В торцах оконного проема нужно просверлить отверстия под крепления решетки. В зависимости от размеров креплений, диаметр отверстий может варьироваться от 12 до 20 мм. * После этого решетка крепится ко всем четырем сторонам оконного проема с помощью специальных крюков-штырей, прижимающих металлическое изделие к стенам. Распашные металлические решетки позволят Вам периодически их раскрывать, как створки. По желанию, Вы можете заказать решетки с одной или двумя подвижными створками. Процесс крепления такой же, какой был описан выше. Однако крепление решетки происходит только в боковых сторонах оконного проема.
Раздвижные решетки имеют систему, похожую на систему раздвижного механизма
Процесс крепления: * При монтаже нужно прикрепить полозы (направляющие шины решетки) к торцам оконного проема для свободного хода конструкции во время раздвигания, а после вставить решетку в созданную раму
* Обратите внимание, что у раздвижных решеток есть свои недостатки: конструкция из склепанной крест-накрест полосы снижает защитные свойства и жесткость. И, наконец, съемные решетки монтируются в межоконный проем
Монтировать их можно как с помощью крюков, так и с использованием ввинчиваемых болтов
И, наконец, съемные решетки монтируются в межоконный проем. Монтировать их можно как с помощью крюков, так и с использованием ввинчиваемых болтов.
Общее строение
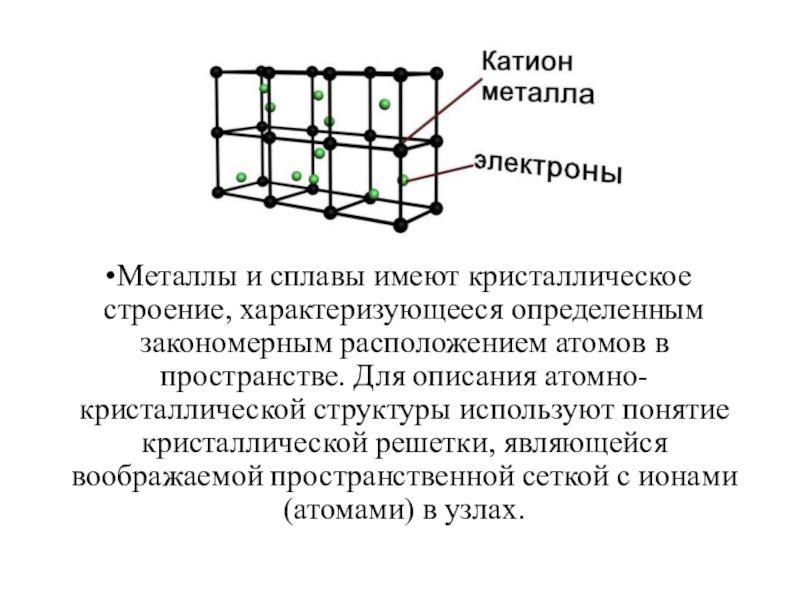
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Виды кристаллических решеток металлов

В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место.
Подтверждение этому: и в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества: и в археологических находках металлических изделий (кованые медные украшения, сельскохозяйственные орудия); и в повсеместном использовании металлов и сплавов в современной технике. Причина этого — в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Материаловедение. Металловедение.
Металлы – один из классов конструкционных материалов, характеризующийся определенным набором свойств:
- «металлический блеск» (хорошая отражательная способность);
- пластичность;
- высокая теплопроводность;
- высокая электропроводность.
Строение металлов. Атомно-кристаллическое строение металлов
Данные свойства обусловлены особенностями строения металлов.
Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны.
На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объему металла, т.е. принадлежать целой совокупности атомов.
Дефекты кристаллического строения. Точечные дефекты.Аллотропия. Полиморфные превращения. Магнитные превращения.
Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Кристаллическая решетка металлов
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка. Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл. Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
- размеры ребер элементарной ячейки. a, b, c – периоды решетки – расстояния между центрами ближайших атомов (в одном направлении выдерживаются строго определенными);
- углы между осями (α, β, χ);
- координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке;
- базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки;
- плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74).
Схема кристаллической решетки
Рис. 1
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа:
- примитивный – узлы решетки совпадают с вершинами элементарных ячеек;
- базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
- объемно-центрированный – атомы занимают вершины ячеек и ее центр;
- гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
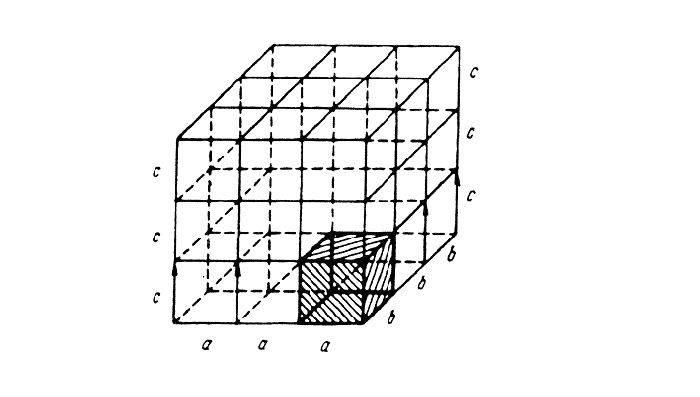 Рис. 3. Кристаллические ячейки составляют решётку.
Рис. 3. Кристаллические ячейки составляют решётку.
Что мы узнали?
Узнали кратко об атомно-кристаллическом строении металлов. Металлы – твёрдые кристаллические вещества. Единицей решётки является элементарная кристаллическая ячейка. Благодаря металлическим связям ионы в узлах ячеек удерживаются на одинаковом расстоянии. Различают три типа кристаллических решёток – ОЦК, ГЦК и ГПУ, отличающихся количеством атомов и геометрической формой.
/5
Вопрос 1 из 5
Ионная кристаллическая решетка

В случае, если в узлах кристалла находятся заряженные частицы – ионы, мы можем говорить о ионной кристаллической решетке. Как правило, с ионных кристаллах чередуются положительные ионы (катионы) и отрицательные ионы (анионы), поэтому частицы в кристалле удерживаются силами электростатического притяжения. В зависимости от типа кристалла и типа ионов, образующих кристалл, такие вещества могут быть довольно прочными и тугоплавкими. В твердом состоянии подвижных заряженных частиц в ионных кристаллах, как правило, нет. Зато при растворении или расплавлении кристалла ионы высвобождаются и могут двигаться под действием внешнего электрического поля. Т.е. проводят ток только растворы или расплавы ионных кристаллов. Ионная кристаллическая решетка характерна для веществ с ионной химической связью. Примеры таких веществ – поваренная соль NaCl, карбонат кальция – CaCO3 и др. Ионную кристаллическую решетку, как правило, в твердой фазе образуют соли, основания, а также оксиды металлов и бинарные соединения металлов и неметаллов.

Связь между частицами в ионных кристаллах: ионная химическая связь.
В узлах кристалла с ионной решеткой расположены ионы.
Фазовое состояние ионных кристаллов при нормальных условиях: как правило, твердые вещества.
Химические вещества с ионной кристаллической решеткой:
- Соли (органические и неорганические), в том числе соли аммония (например, хлорид аммония NH4Cl);
- Основания;
- Оксиды металлов;
- Бинарные соединения, в составе которых есть металлы и неметаллы.
Физические свойства веществ с ионной кристаллической структурой:
— высокая температура плавления (тугоплавкость);
— растворы и расплавы ионных кристаллов – проводники тока;
— большинство соединений растворимы в полярных растворителях (вода);
— твердое фазовое состояние у большинства соединений при нормальных условиях.
Реальный кристалл металла
Какой бы химический металлический элемент не рассматривался, в действительности он представляет собой твердое вещество, в котором маленькие монокристаллы (зерна) соединены друг с другом в различных ориентациях. Такая структура образует поликристалл. В нем, помимо границ зерен, присутствуют дефекты всех четырех типов, включая примеси таких неметаллов, как кислород, азот и водород. Последний из-за своих размеров легко проникает в любую кристаллическую решетку, образует с ее ионами твердые фазы, которые приводят к охрупчиванию металла, что является одной из актуальных проблем металловедения.
Соли
Важным продуктом, содержащим щелочной металл, является сода Na2CO3. Основное количество соды во всём мире производят по методу Сольве, предложенному ещё в начале XX века. Суть метода состоит в следующем: водный раствор NaCl, к которому добавлен аммиак, насыщают углекислым газом при температуре 26—30 °C. При этом образуется малорастворимый гидрокарбонат натрия, называемый питьевой содой:
{\mathsf {NaCl+\ NH_{3}+\ CO_{2}+\ H_{2}O\longrightarrow \ NaHCO_{3}\downarrow +\ NH_{4}Cl)) Аммиак добавляют для нейтрализации кислотной среды, возникающей при пропускании углекислого газа в раствор, и получения гидрокарбонат-иона HCO3−, необходимого для осаждения гидрокарбоната натрия. После отделения питьевой соды раствор, содержащий хлорид аммония, нагревают с известью и выделяют аммиак, который возвращают в реакционную зону:
{\mathsf {2\ NH_{4}Cl+\ Ca(OH)_{2}\longrightarrow 2\ NH_{3}\uparrow +\ CaCl_{2}+2\ H_{2}O)) Таким образом, при аммиачном способе получения соды единственным отходом является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
При прокаливании гидрокарбоната натрия получается кальцинированная, или стиральная, сода Na2CO3 и диоксид углерода, используемый в процессе получения гидрокарбоната натрия:
{\mathsf {2\ NaHCO_{3}\longrightarrow \ Na_{2}CO_{3}+\ CO_{2}\uparrow +\ H_{2}O)) Основной потребитель соды — стекольная промышленность.
В отличие от малорастворимой кислой соли NaHCO3, гидрокарбонат калия KHCO3 хорошо растворим в воде, поэтому карбонат калия, или поташ, K2CO3 получают действием углекислого газа на раствор гидроксида калия:
{\mathsf {2\ KOH+\ CO_{2}\longrightarrow \ K_{2}CO_{3}+\ H_{2}O)) Поташ используют в производстве стекла и жидкого мыла.
Литий — единственный щелочной металл, для которого не получен гидрокарбонат. Причина этого явления в очень маленьком радиусе иона лития, который не позволяет ему удерживать довольно крупный ион HCO− 3.