Магические и лечебные свойства
О необычайных возможностях камня сложно говорить — это ненатуральный материал. Всё, что выращено в лаборатории не обладает магическими свойствами. Такие соединения синтезируются за несколько часов. Они порождение не Земли, а человеческого ума.
В карборунде этого нет. Он пустой. Если же удастся раздобыть украшение с ним, стоит помнить, что любая пустота рано или поздно чем-то наполняется. Так и с камнем. Владелец передаёт ему энергетику, предопределяя действие камня.
Если долго носить кольцо с искусственным минералом и постоянно копить в себе негатив, выплёскивать его наружу, то когда-то камень перенасытится этой информацией и начнёт её передавать хозяину и всем окружающим. Это станет негативный и злой талисман, который начнёт нести горе.
Чтобы этого избежать, в присутствии камня надо думать о хорошем, загадывать добрые желания и хвалить себя. Талисман можно смело передавать по наследству — он будет защищать всю семью. Но на создание семейной реликвии уйдут десятилетия.
Карборунд — распространённый в промышленности и редкий в ювелирном деле материал. Если же удастся найти с ним украшение — оно будет служить долго и впечатлять блеском.
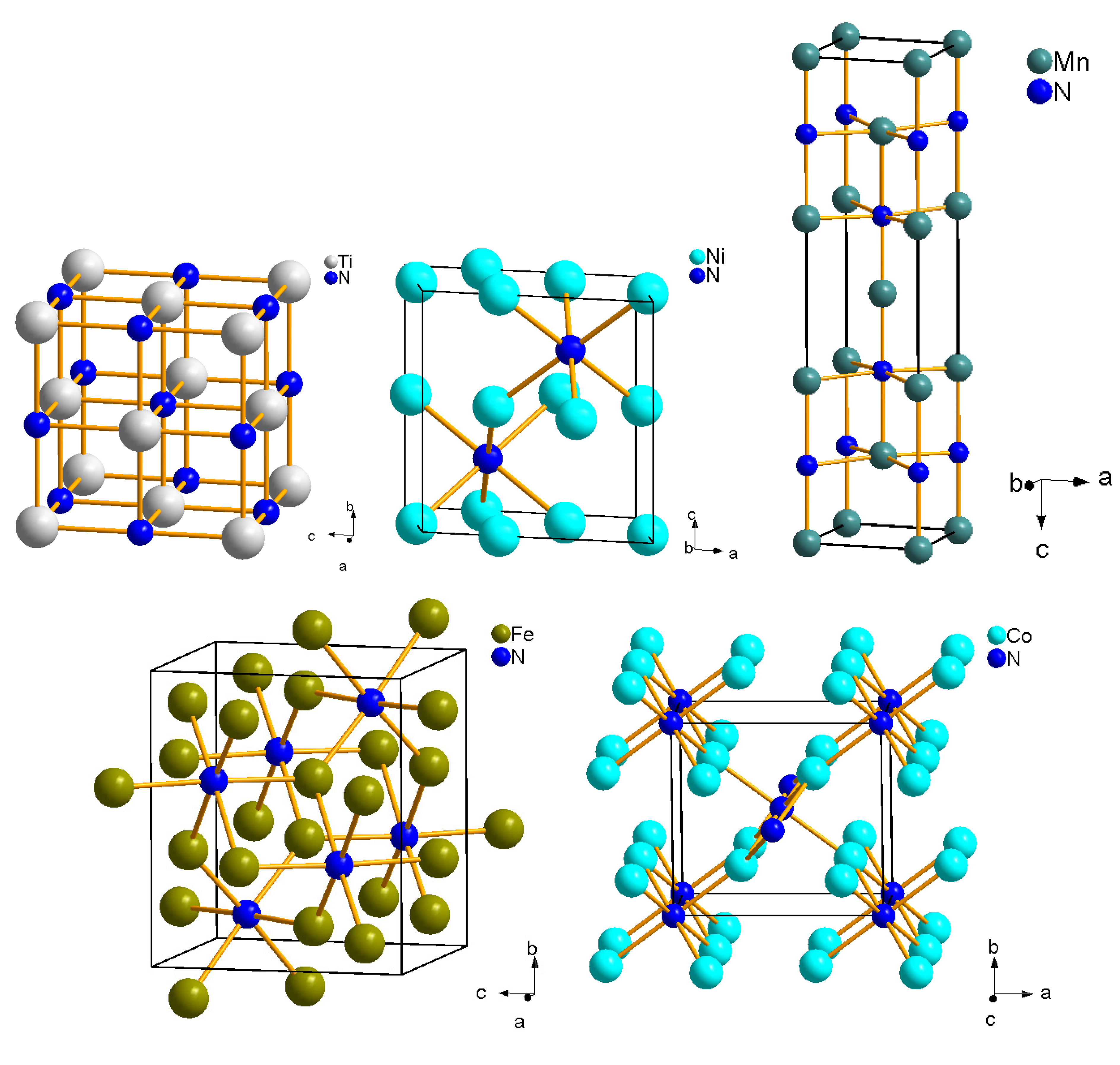
Основные металлические карбиды
На практике широко применяется множество карбидных соединений. Рассмотрим основные из них.
Карбид гафния
Встречается в виде только одного вещества — HfC. В нормальных условиях обладает кристаллической структурой, окрашено в серый цвет. плавится при температуре 3900 градусов — интересно, что его закипание происходит уже при температуре 4160 градусов. Поэтому к расплавлению нужно подходить аккуратно, чтобы не испарить его. При нагреве до 2000 градусов начинает взаимодействовать с металлами (молибден, вольфрам). Вещество не обладает полной химической инертностью — оно вступает в реакцию с кислотами (в азотной или серной кислоте оно способно полностью раствориться).

Карбиды хрома
Встречается в виде нескольких веществ; основные — Cr23C6, Cr3C2, Cr7C3. Отличаются высокой химической инертностью (хотя могут реагировать с цинком при сильном нагреве). Не вступают в контакт с водой, атмосферным воздухом, кислотами, щелочами, солями, другими карбидными соединениями. Температура плавления не слишком высокое — большинство соединений плавятся уже при температуре 1500-1700 градусов. У соединения Cr7C3 при нагреве до 800 градусов происходит ряд эндотермических реакций и превращений, что приводит к превращению вещества в Cr23C6.
Карбид титана
Встречается в виде одного стабильного соединения — TiC. При нормальных условиях обладает серым цветом с характерным металлическим блеском. Плавится при температуре 3100 градусов, кипит — при 4305 градусах. Обладает высокой устойчивостью, прочностью. Химическая инертность средняя — в нормальном состоянии может вступать в реакцию с кислотами и щелочами (хотя реакция идет слабо). При нагреве до 2500 градусов может вступать в реакцию с азотом (в том числе — атмосферным). При нагреве до 1200 градусов может окисляться и/или вступать в реакцию с углекислым газом.
Карбиды вольфрама
Встречается в виде двух устойчивых соединений — WC и W2C. Оба карбида отличаются приблизительно одинаковыми химико-физическими свойствами. Вид — мелкий порошок серовато-черного цвета (со слабым металлическим блеском или без него). Вещества плавятся при температуре около 2720 градусов, однако при более низких температурах начинается их активных контакт с атмосферным воздухом, азотом или углекислым газом. Соединения легко растворяются в разогретых до температуре кипения серных и азотных кислотах.
Карбид кальция
Основное устойчивое соединение — CaC2. Вид — крупные прозрачные кристаллы, которые могут обладать светло-голубым оттенком. При наличии примесей может окрашиваться в другие цвета — серый, желтый, коричневый, черный и другие (в зависимости от типа примеси и ее концентрации). Соединение плавится при температуре порядка 2500 градусов, однако при комнатной температуре оно активно вступает в реакцию с водой с активным выделением ацетилена. Поэтому вещество нуждается в особых безопасных способах хранения (ацетилен является токсичным для человека).
Карбид циркония
Основное соединение — ZrC. Стандартное состояние — небольшие кристаллы серого цвета, обладающие металлическим блеском. Температура плавления — 3530 градусов, однако при нагреве до 1200 градусов вещество начинает активно вступать в реакцию с атмосферным кислородом, что приводит к образованию оксидов. Вещество слабо реагирует с кислотами, щелочами и солями, однако может вступать в реакцию с атомизированным азотом в составе сложных веществ, что приводит к образованию нитритов. Поэтому вещество нуждается в особых способах хранения.

Физические свойства
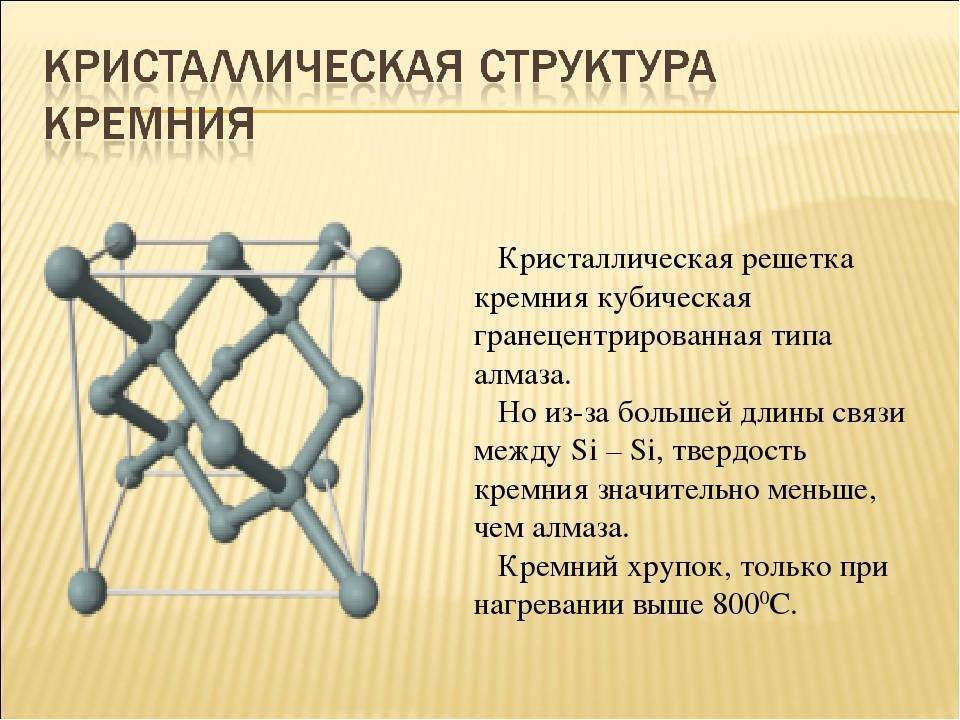
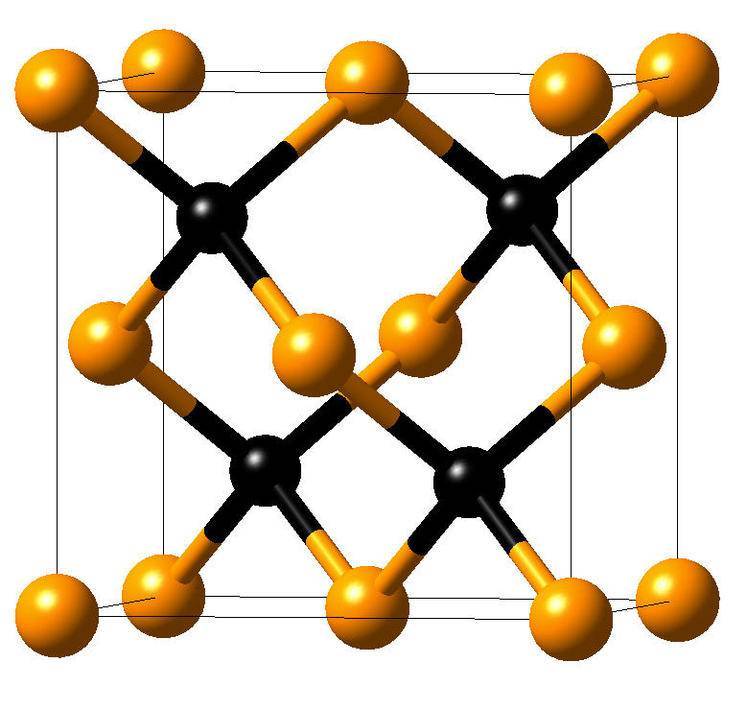
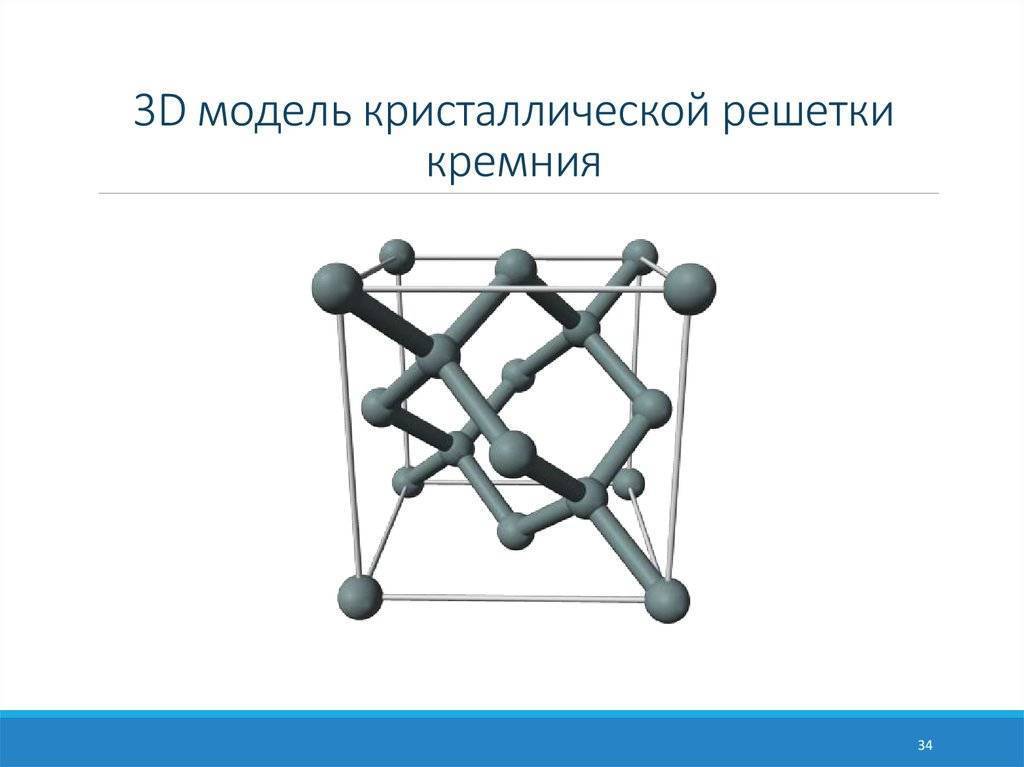
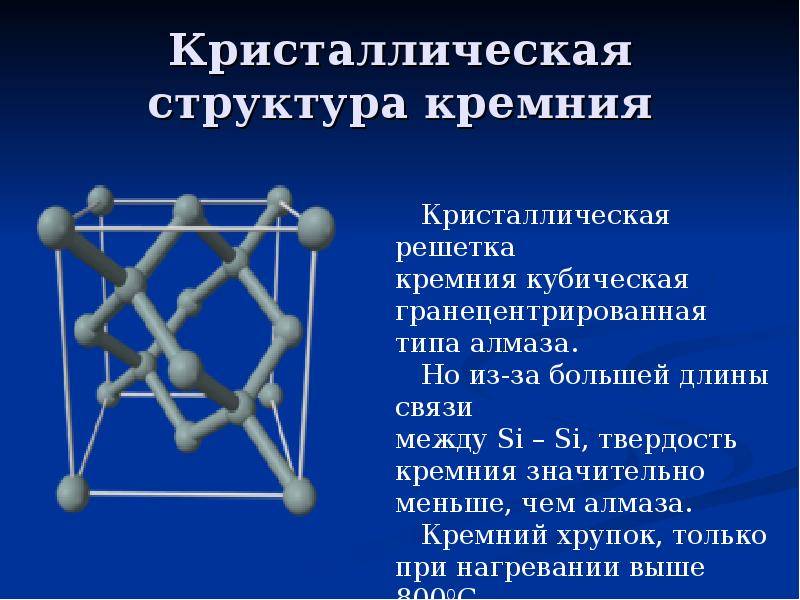
Кристаллическая структура кремния.
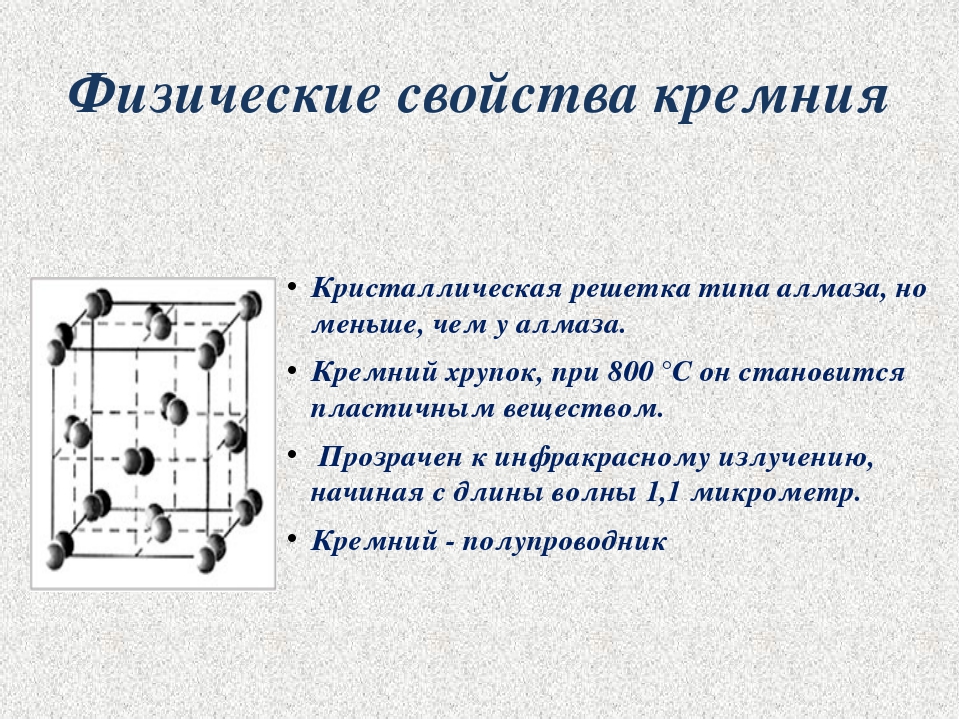
Кристаллическая решётка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), но из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твёрдость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Он прозрачен для инфракрасного излучения начиная с длины волны 1,1 мкм. Собственная концентрация носителей заряда — 5,81⋅1015 м−3 (для температуры 300 K).
Схематическое изображение зонной структуры кремния
Электрофизические свойства
Элементарный кремний в монокристаллической форме является непрямозонным полупроводником. Ширина запрещённой зоны при комнатной температуре составляет 1,12 эВ, а при Т = 0 К — 1,21 эВ. Концентрация собственных носителей заряда в кремнии при нормальных условиях составляет около 1,5⋅1010 см−3.
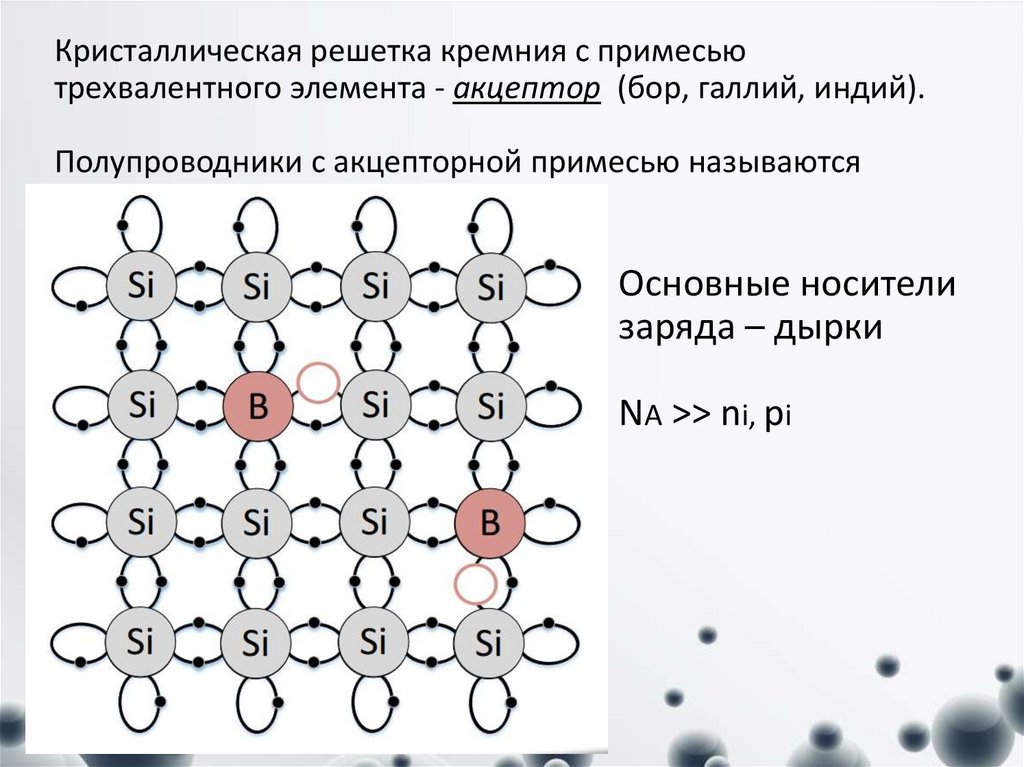
На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нём примеси. Для получения кристаллов кремния с дырочной проводимостью в кремний вводят атомы элементов III группы, таких, как бор, алюминий, галлий, индий. Для получения кристаллов кремния с электронной проводимостью в кремний вводят атомы элементов V группы, таких, как фосфор, мышьяк, сурьма.
При создании электронных приборов на основе кремния используется преимущественно приповерхностный слой монокристалла (толщиной до десятков мкм), поэтому качество поверхности кристалла может оказывать существенное влияние на электрофизические свойства кремния и, соответственно, на свойства созданного электронного прибора. При создании некоторых приборов используется технология, модифицирующая поверхность монокристалла, например, обработка поверхности кремния различными химическими реагентами и её облучение.
- Диэлектрическая проницаемость: 12
- Подвижность электронов: 1200—1450 см²/(В·c).
- Подвижность дырок: 500 см²/(В·c).
- Ширина запрещённой зоны 1,21 эВ при 0 К.
- Время жизни свободных электронов: 5 нс — 10 мс
- Длина свободного пробега электронов: порядка 1 мм.
- Длина свободного пробега дырок: порядка 0,2—0,6 мм.
Все значения приведены для нормальных условий.
Структура и свойства
 | ||
| (β) 3C-SiC | 4H-SiC | (α) 6H-SiC |
Карбид кремния, изображение, полученное под стереоскопическим микроскопом.
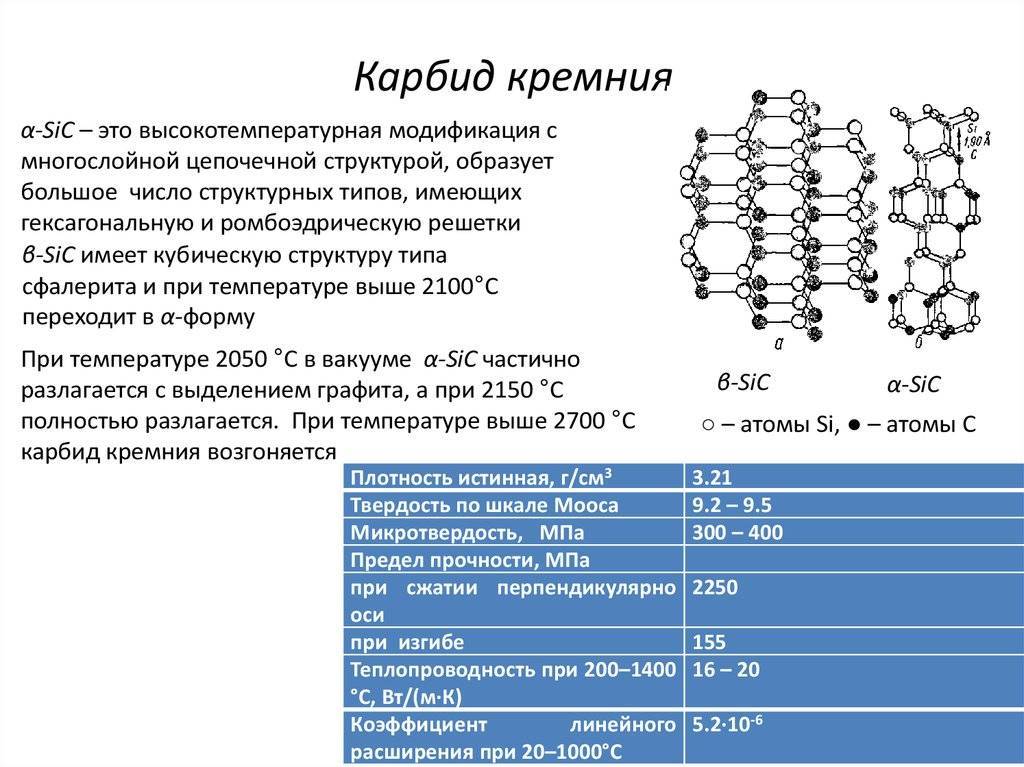
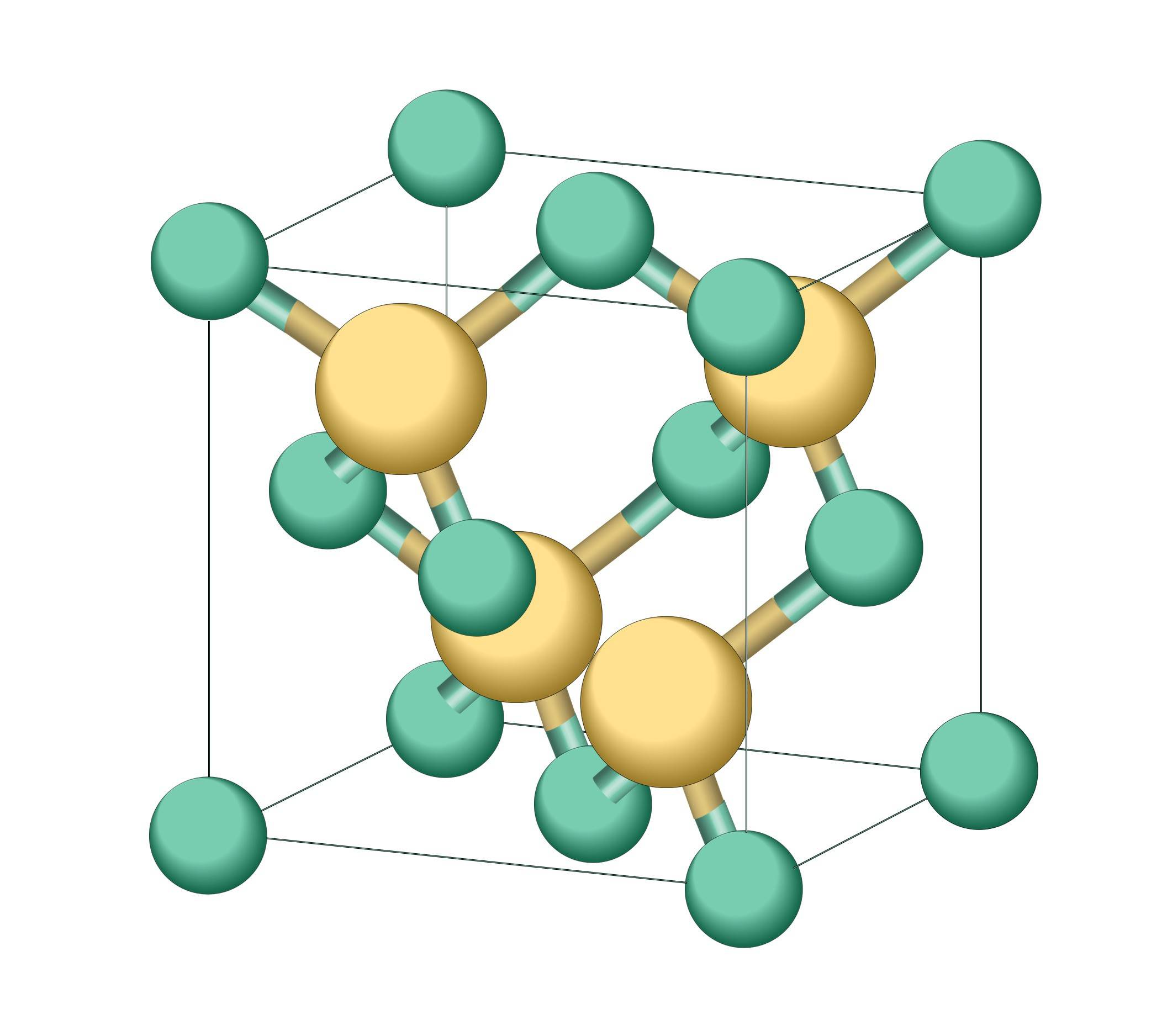
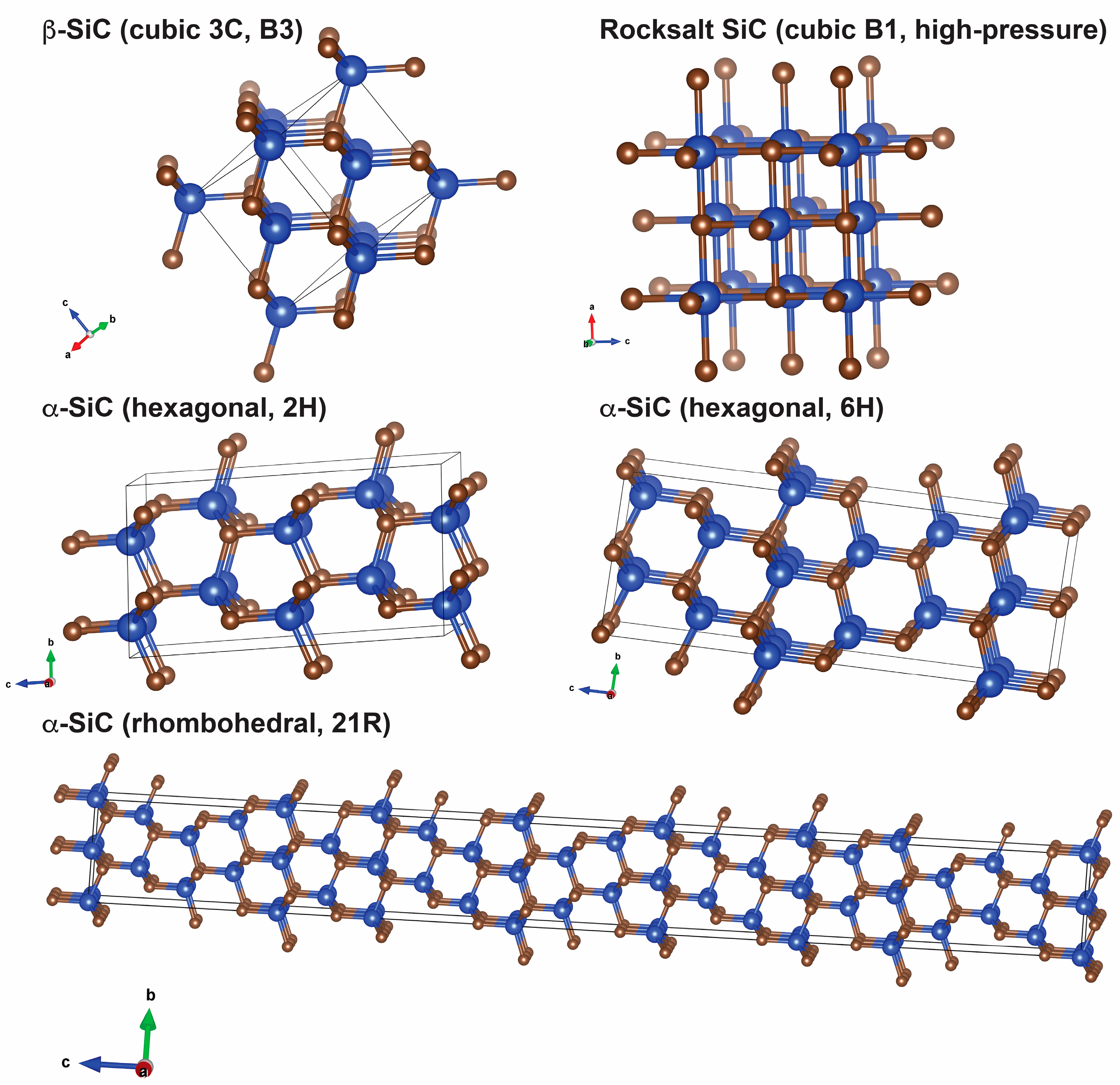
Карбид кремния существует примерно в 250 кристаллических формах. Путем пиролиза прекерамических полимеров в инертной атмосфере образуется также карбид кремния в стеклообразной аморфной форме. Полиморфизм SiC характеризуется большим семейством подобных кристаллических структур, называемых политипами. Это разновидности одного и того же химического соединения, которые идентичны в двух измерениях и различаются в третьем. Таким образом, их можно рассматривать как слои, уложенные в определенной последовательности.
Альфа-карбид кремния (α-SiC) является наиболее часто встречающимся полиморфом , образуется при температурах выше 1700 ° C и имеет гексагональную кристаллическую структуру (подобную вюрциту ). Бета-модификация (β-SiC) с кристаллической структурой цинковой обманки (аналогичной алмазу ) образуется при температурах ниже 1700 ° C. До недавнего времени бета-форма имела относительно немного коммерческих применений, хотя в настоящее время растет интерес к ее использованию в качестве носителя для гетерогенных катализаторов из-за ее большей площади поверхности по сравнению с альфа-формой.
| Политип | 3C (β) | 4H | 6H (α) |
|---|---|---|---|
| Кристальная структура | Цинковая обманка (кубическая) | Шестиугольный | Шестиугольный |
| Космическая группа | Т 2 д -F 4 3м | С 4 6v -P6 3 тс | С 4 6v -P6 3 тс |
| Символ Пирсона | cF8 | hP8 | HP12 |
| Константы решетки (Å) | 4,3596 | 3.0730; 10,053 | 3.0810; 15.12 |
| Плотность (г / см 3 ) | 3,21 | 3,21 | 3,21 |
| Ширина запрещенной зоны (эВ) | 2.36 | 3,23 | 3,05 |
| Объемный модуль (ГПа) | 250 | 220 | 220 |
| Теплопроводность (Вт⋅м −1 ⋅K −1 ) @ 300 K (см. Температурную зависимость) | 360 | 370 | 490 |
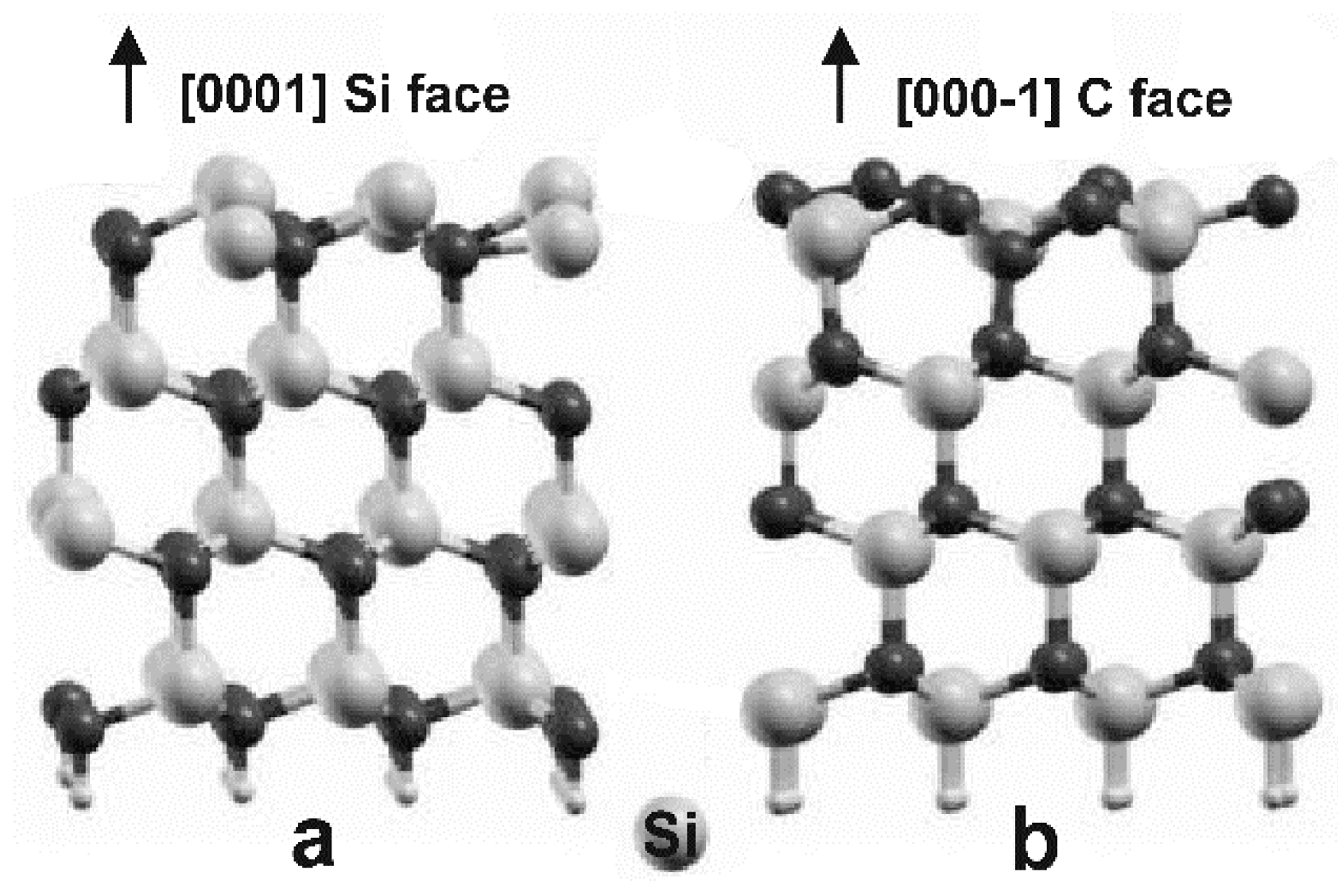
Чистый SiC бесцветен. Цвет промышленного продукта от коричневого до черного возникает из-за примесей железа . Радуги , как блеск кристаллов происходят из – за помехи тонкопленочных о наличии пассивирующего слоя из диоксида кремния , который образуется на поверхности.
Высокая температура сублимации SiC (около 2700 ° C) делает его полезным для подшипников и деталей печей. Карбид кремния не плавится ни при какой известной температуре. Он также очень инертен химически. В настоящее время существует большой интерес к его использованию в качестве полупроводникового материала в электронике, где его высокая теплопроводность, высокая пробивная напряженность электрического поля и высокая максимальная плотность тока делают его более перспективным, чем кремний, для устройств большой мощности. SiC также имеет очень низкий коэффициент теплового расширения (4,0 × 10 -6 / K) и не испытывает фазовых переходов, которые могли бы вызвать скачки в тепловом расширении.
Электрическая проводимость
Карбид кремния – это полупроводник , который может быть легирован азотом или фосфором n-типа и бериллием , бором , алюминием или галлием p-типа . Металлическая проводимость была достигнута за счет сильного легирования бором, алюминием или азотом.
Сверхпроводимость была обнаружена в 3C-SiC: Al, 3C-SiC: B и 6H-SiC: B при той же температуре 1,5 К. Однако наблюдается существенная разница в поведении магнитного поля между легированием алюминия и бором: SiC: Al относится к типу II , как SiC: B. Напротив, SiC: B является тип-I . В попытке объяснить эту разницу было отмечено, что узлы Si более важны, чем узлы углерода для сверхпроводимости в SiC. В то время как бор замещает углерод в SiC, Al замещает позиции Si. Следовательно, Al и B «видят» разные среды, которые могут объяснить разные свойства SiC: Al и SiC: B.
В виде структурированной керамики
— В процессе, известном как спекание, частицы карбида кремния и частицы родственных частиц нагреваются до температуры ниже температуры плавления соединения. Это повышает прочность и долговечность керамического изделия за счет образования прочных связей между частицами.
— Широко используется структурная керамика из карбида кремния. Они используются в дисковых тормозах и сцеплениях автомобилей, в сажевых фильтрах и в качестве добавки к маслу для снижения трения.
— Структурная керамика из карбида кремния в настоящее время широко используется для компонентов, подвергающихся воздействию высоких температур. Например, горловины сопел ракет и цилиндры печей.
— Сочетание высокой теплопроводности, твердости и стабильности при высоких температурах делает трубчатые детали теплообменников из карбида кремния идеальным материалом.
— Структурная керамика используется для изготовления пескоструйных сопел, уплотнений автомобильных водяных насосов, подшипников и пресс-форм. Он также является предпочтительным материалом для тиглей при плавке металлов.
— Он является частью нагревательных элементов, используемых при плавлении стекла и цветных металлов, а также при термической обработке металлов.
Физические свойства
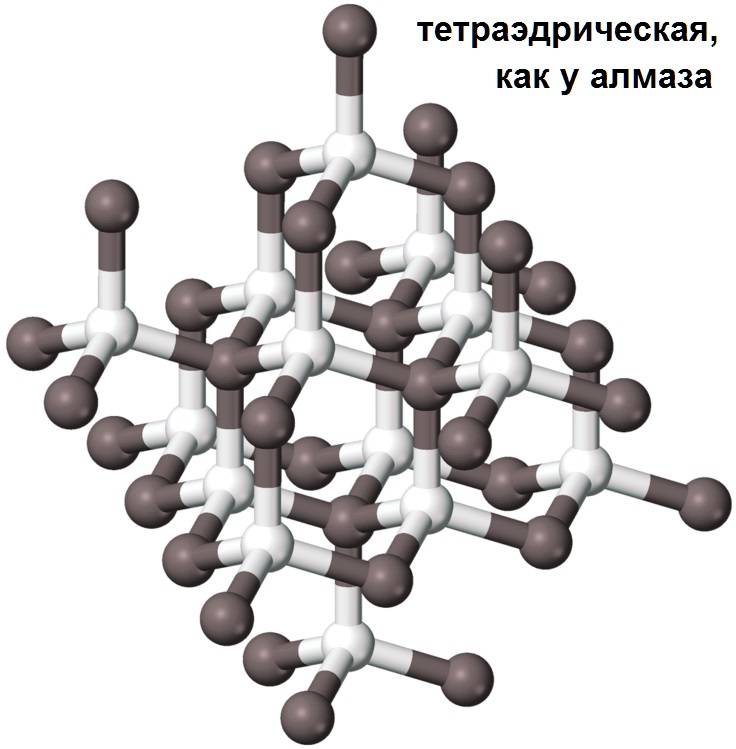
Кристаллическая структура кремния.
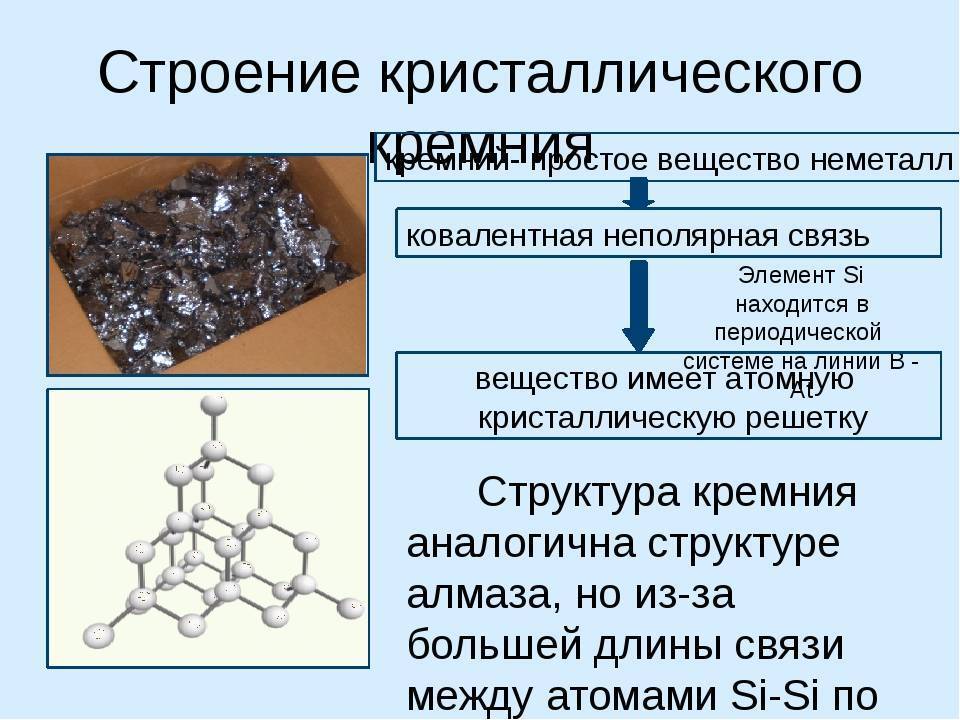
Кристаллическая решётка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), но из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твёрдость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Он прозрачен для инфракрасного излучения начиная с длины волны 1,1 мкм. Собственная концентрация носителей заряда — 5,81⋅1015 м−3 (для температуры 300 K).
Схематическое изображение зонной структуры кремния
Электрофизические свойства
Элементарный кремний в монокристаллической форме является непрямозонным полупроводником. Ширина запрещённой зоны при комнатной температуре составляет 1,12 эВ, а при Т = 0 К — 1,21 эВ. Концентрация собственных носителей заряда в кремнии при нормальных условиях составляет около 1,5⋅1010 см−3.
На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нём примеси. Для получения кристаллов кремния с дырочной проводимостью в кремний вводят атомы элементов III группы, таких, как бор, алюминий, галлий, индий. Для получения кристаллов кремния с электронной проводимостью в кремний вводят атомы элементов V группы, таких, как фосфор, мышьяк, сурьма.
При создании электронных приборов на основе кремния используется преимущественно приповерхностный слой монокристалла (толщиной до десятков мкм), поэтому качество поверхности кристалла может оказывать существенное влияние на электрофизические свойства кремния и, соответственно, на свойства созданного электронного прибора. При создании некоторых приборов используется технология, модифицирующая поверхность монокристалла, например, обработка поверхности кремния различными химическими реагентами и её облучение.
- Диэлектрическая проницаемость: 12
- Подвижность электронов: 1200—1450 см²/(В·c).
- Подвижность дырок: 500 см²/(В·c).
- Ширина запрещённой зоны 1,21 эВ при 0 К.
- Время жизни свободных электронов: 5 нс — 10 мс
- Длина свободного пробега электронов: порядка 1 мм.
- Длина свободного пробега дырок: порядка 0,2—0,6 мм.
Все значения приведены для нормальных условий.
Сфера применения
Древесный уголь используется в промышленности в следующих целях:
- для применения в составе фильтров;
- для плавки кристаллического кремния;
- для использования в металлургии (насыщение стали углеродом, получение чистых сплавов);
- для производства стекла, некоторых видов пластмасс, красок;
- для изготовления натурального красителя для пищевой промышленности;
- для изготовления активированного угля;
- для использования в сельском хозяйстве;
- для применения в качестве удобного бытового топлива для печей, каминов, мангалов.
При сжигании в печах и каминах данный вид топлива сгорает практически без языков пламени, обеспечивая ровный и интенсивный жар. Наиболее высоко ценится продукт марки А, который изготавливается из твердых пород древесины.
Получение карбида кремния
Наибольшее количество природного происхождения карбида кремния содержится в космическом пространстве: на пылевых облаках, окружающих звезды, в метеоритах. На Земле этот материал присутствует только на месторождениях кимберлита или корунда, что усложняет процесс его добычи в промышленных масштабах. По этой причине карборунд, используемый в современной индустриальных сферах и бытовых условиях, является искусственным. Самым распространенным способом получения этого химического соединения является нагревание двуокиси кремния углеродом в специализированных печах, работающих на электричестве. Вещество нагревается до температуры 1800-2300 °C.Источниками кремния являются кварцевый песок, очищенный от примесей, и антрацит. Для улучшения газопроницаемости материала используются опилки из древесины. Цвет синтетического карборунда изменяется при помощи добавления хлорида натрия (поваренной соли). Увеличение плотности материала производится при помощи прессования. После этих процессов структурные частицы меняют свое местоположения, что приводит к деформации твердого раствора.

Также данное вещество получают при помощи следующих методов:
- Сублимация. Это технология предоставляет выращивать зерна карбида кремния природных материалов. Рост кристаллов осуществляется в графитовых тиглях из газовой фазы. Получить карборунд при помощи этой технологии можно из инертных газов, нагретых до температуры 2600 °C.
- Эпитаксия. Этот способ используется для получения твердых растворов карбида кремния. В нем используется водород, предварительно очищенный от примесей при помощи диффузионных методов. Химический элемент вступает в реакцию со свободным углеродом, что приводит к образованию полупроводниковых пленок.
- Синтез. Сырьем для получения карборунда является графит, измельченный до порошкообразного состояния. Также для получения необходимого материала можно использовать сажу с размером частиц не более 20 мкм. Синтез химических веществ происходит в твердой фазе, что обусловлено большим расстоянием между атомами углерода и кремния.
- Приготовление шихты. Для этого метода требуются компоненты, содержащие большое количество углерода и кремния. В качестве сырья могут использоваться нанопорошки, углеводы или многоатомные спирты. Приготовление шихты осуществляется в деионизованной воде в течение 5,5 часов. Материал нагревается ступенчато до температуры 1650 °С.
Для промышленных нужд чаще всего изготавливают карбиды зеленого и черного цветов. Особенности их химического состава определены в ГОСТ 26327-84. В нем указаны 4 марки карбида кремния: 53С, 54С, 63С и 64С.
Открытие и начало производства[ | ]
Повторение эксперимента Г. Д. Раунда
О ранних, не систематических и часто непризнанных синтезах карбида кремния сообщали Деспретз (1849), Марсден (1880) и Колсон (1882 год). Широкомасштабное производство начал Эдвард Гудрич Ачесон в 1893. Он запатентовал метод получения порошкообразного карбида кремния 28 февраля 1893. Ачесон также разработал электрическую печь, в которой карбид кремния создаётся до сих пор.
Исторически первым способом использования карбида кремния было использование в качестве абразива. За этим последовало применение и в электронных устройствах. В начале XX века карбид кремния использовался в качестве детектора в первых радиоприемниках. В 1907 году Генри Джозеф Раунд создал первый светодиод, подавая напряжение на кристаллы SiC и наблюдая за жёлтым, зелёным и оранжевым излучением на катоде. Эти эксперименты были повторены О. В. Лосевым в СССР в 1923 году.
Синтетические кристаллы SiC ~ 3 мм в диаметре
Чистота карбида кремния, образующегося в печи Ачесона, зависит от расстояния до графитовогорезистора в ТЭНе.
Чистый карбид кремния можно получить с помощью так называемого процесса Лели, в котором порошкообразный SiC возгоняется в атмосфере аргона при 2500 °C и осаждается на более холодной подложке в виде чешуйчатых монокристаллов размерами до 2×2 см. Этот процесс даёт высококачественные монокристаллы, получающиеся из-за быстрого нагрева до высоких температур и в основном состоящие из 6H-SiC фазы.
Чистый карбид кремния также может быть получен путём термического разложения полимера полиметилсилана (SiCH3)n, в атмосфере инертного газа при низких температурах. Относительно CVD-процесса метод пиролиза более удобен, поскольку из полимера можно сформировать изделие любой формы перед запеканием в керамику.
Предлагаем ознакомиться Куб циркон что это
Производственное применение стабильного оксида
До того времени, как его свойства не были исследованы досконально, кремнезем использовался лишь для изготовления стройматериалов (цемент, бетон). Но по мере его дальнейшего изучения сферы применения значительно расширились:

- Крупные кристаллы кварца популярны в ювелирном деле — в качестве полудрагоценных камней (например, горный хрусталь, опал).
- В промышленности — авиационная индустрия, оптика, электроника.
- При производстве зубной пасты — как «мягкий» абразив.
- В качестве огнеупорного вещества в сталелитейном производстве.
- В фармацевтической отрасли (как загуститель) — при производстве мазей, суспензий, гелей.
- При производстве ядохимикатов (средство для борьбы с клопами «Гектор») — порошок не отравляет насекомых, но он выводит воду из их организма, что приводит к последующему обезвоживанию и гибели вредителей.
- В пищевой промышленности — как стабилизатор суспензий, загуститель, порошок для фильтрации (в производстве пива, масел, натуральных соков), для предотвращения слеживания и комкования сыпучих продуктов (сахара, муки, соли). Кроме того, этот материал используется как энтеросорбент и даже самостоятельная пищевая добавка (E551 — в сырах, специях, сухих завтраках).
Однако вдыхание пыли двуокиси кремния может привести к появлению проблем со стороны дыхательной системы — бронхиту, реже — силикозу легких (заболеванию, снижающему способность легких перерабатывать кислород) и даже спровоцировать развитие онкозаболеваний.
Химические свойства
Схема атома кремния
В соединениях кремний склонен проявлять степень окисления +4 или −4, так как для атома кремния более характерно состояние sp³-гибридизации орбиталей. Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Химически кремний малоактивен. При комнатной температуре реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. При нагревании до температуры 400—500°C кремний реагирует с кислородом с образованием диоксида SiO2, с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (—Si—Si—Si—).
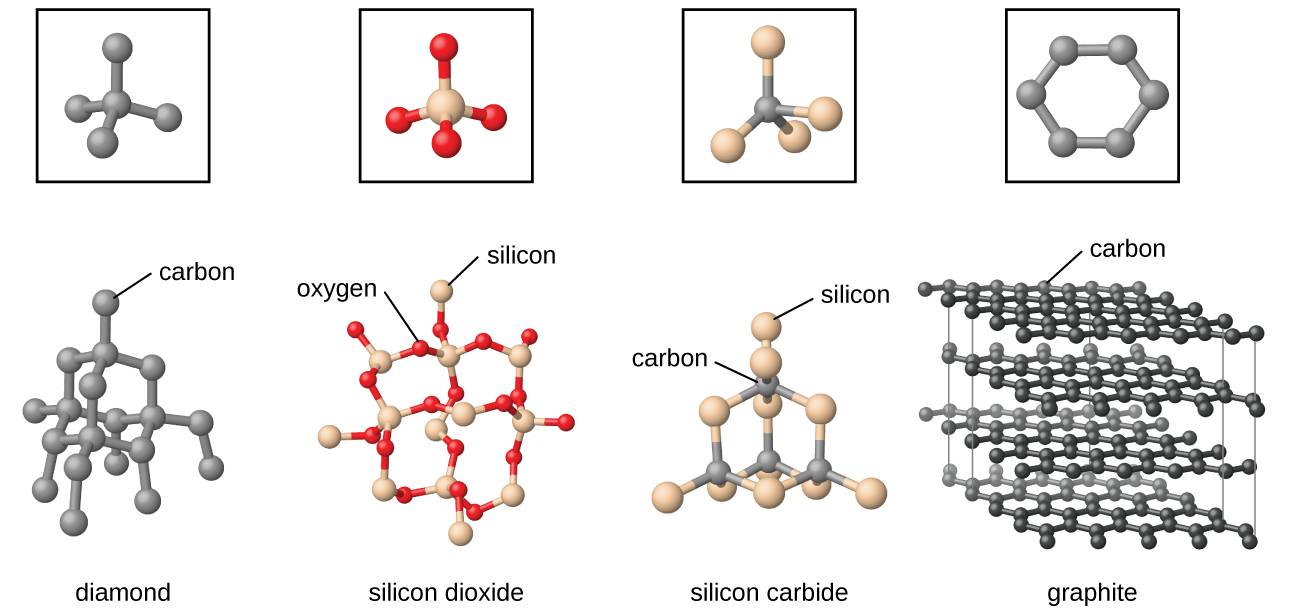
С азотом кремний при температуре около 1000 °C образует нитрид Si3N4, с бором — термически и химически стойкие бориды SiB3, SiB6 и SiB12. Соединение кремния и его ближайшего аналога по таблице Менделеева — углерода — карбид кремния SiС (карборунд) характеризуется высокой твердостью и низкой химической активностью. Карборунд широко используется как абразивный материал.
При нагревании кремния с металлами возникают силициды. Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C). Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
При восстановлении SiO2 кремнием при высоких температурах образуется оксид кремния (II) SiO.
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены еще два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др.
Структура и свойства
Известно примерно 250 кристаллических форм карбида кремния. Полиморфизм SiC характеризуется большим количеством схожих кристаллических структур, называемых политипами. Они являются вариациями одного и того же химического соединения, которые идентичны в двух измерениях, но отличаются в третьем. Таким образом, их можно рассматривать как слои, сложенные в стопку в определённой последовательности.
Альфа-карбид кремния (α-SiC) является наиболее часто встречающимся полиморфом. Эта модификация образуется при температуре свыше 1700 °C и имеет гексагональную решётку, кристаллическая структура типа вюрцита.
Карборунд: внешний вид и свойства
Будучи синтетическим, карбид кремния перенимает свойства природного муассанита. При этом его гораздо легче получить. Неорганическое бинарное углеродное соединение образует кристаллы, схожие внешне с антрацитом, но обладающие радужными переливами. Обычно кристаллы бесцветны и блестят, но технический карборунд порой приобретает различные цветовые оттенки из-за присутствия железных примесей.
Природный муассанит интересен своими уникальными свойствами. Он обладает поразительной, близкой к алмазу, твердостью, является инертным (не вступает в химические реакции с большинством кислот), выдерживает нагревание до 1500°С и воздействие радиации. Помимо этого, муассанит механически прочен и стабилен по части физических свойств. Редкость не позволяет использовать его полезные качества в промышленности, поэтому был создан синтетический аналог с теми же качествами.
Купить карбид кремния намного проще, чем муассанит. Его стоимость также ниже, что значительно повышает доступность.