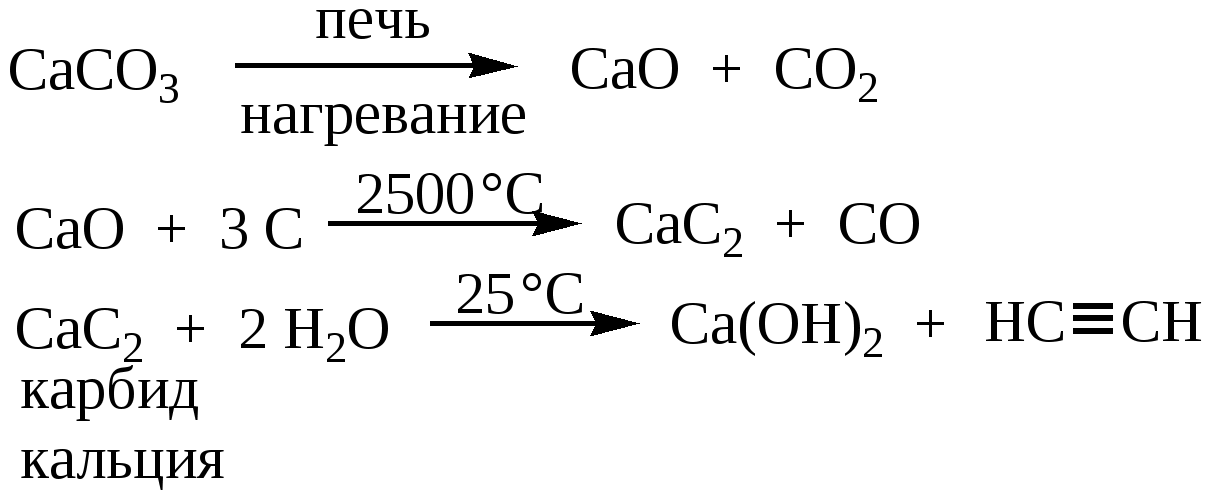Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,203
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Методы получения карбидов
Карбиды могут быть получены взаимодействием углерода и его соединений с металлами или их соединениями. Известны следующие способы получения карбидов: 1) получение карбидов в литом виде;
2) науглероживание порошков металлов (или окислов) твердым углеродом;
3) науглероживание порошков металлов (или окислов) газами, содержащими углерод (часто в присутствии твердого углерода);
4) осаждение из газовой фазы (метод наращивания);
5) химическое выделение карбидной фазы или углеродистых ферросплавов или расплавов (метод растворения);
6) электролиз расплавов соответствующих солей.
Промышленное применение имеют первые три способа.
Получение литых карбидов основано на сплавлении металлов с углеродом и возможно только в электрической или высокочастотной печи, так как температуры образования и плавления карбидов тугоплавких металлов лежат в пределах 2500—4000° С. Это вызывает определенные технические трудности, поэтому способ получения литых карбидов имеет ограниченное применение.
Получение карбидов науглероживанием порошков металлов или окислов металлов твердым углеродом имеет наибольшее распространение и используется для промышленного приготовления карбидов вольфрама, титана, молибдена, тантала, ванадия и других карбидов, применяемых в производстве твердых сплавов.
В качестве исходного сырья при этом способе используют порошки чистых металлов или их окислов. Углерод вводят в смесь в виде тонкого порошка сахарного угля или сажи. Смесь металла (или окисла) с углеродом тщательно перемешивают в шаровых мельницах всухую или мокрым способом. При смешивании металла с твердым углеродом дают от 5 до 10% избытка углерода (по сравнению с теоретическим содержанием его), так как в металлических порошках имеется остаточный кислород, а также для компенсации частичного выгорания углерода в печи.
При использовании смесей окислов металла с углеродом учитывают науглероживающее действие образующейся окиси углерода и применяемого защитного газа. Обычно для реакции достаточно 80—90%-ного количества углерода, которое соответствует уравнению
Науглероживание (карбидизацию) проводят в одну или несколько стадий в электрических или реже в газовых печах. Кроме муфельных печей непрерывного действия, применяют угольные трубчатые печи сопротивления, методические печи с молибденовыми нагревателями и вертикальные трехфазные криптоловые печи, а также высокочастотные печи периодического действия с графитовыми тиглями.
В качестве защитного газа используют водород, окись углерода, метан и смеси этих газов. При получении карбидов волфрама и молибдена в качестве защитного газа можно использовать генераторный газ или диссоциированный аммиак.
Реакция науглероживания при образовании монокарбидов протекает по следующим уравнениям:

Температура реакции науглероживания металлов с твердым углеродом в зависимости от вида карбидов лежит в пределах 1200—2200° С. В табл. 10 приведены температуры реакций получения наиболее важных карбидов из металлов или окислов при науглероживании твердым углеродом в присутствии углеводорода.

Карбиды молибдена, вольфрама и тантала лучше всего получать науглероживанием металлических порошков сажистым углеродом при температуре 1200—1600°С.
Вольфрам образует два стойких при комнатной температуре карбида: W2C и WC. При науглероживании в твердом состоянии образуется преимущественно монокарбид вольфрама WC, при науглероживании в расплаве образуется W2C. Металлокерамические твердые сплавы содержат исключительно монокарбид вольфрама.
Карбид титана готовят из смеси возможно более чистой двуокиси титана с газовой сажей при температуре 1700—2100° С.
Получение карбидов науглероживанием металловили окислов углеродсодержащими газами. Выше было показано, что при карбидизации в твердом состоянии науглероживание частично происходит и через газовую фазу. В связи с этим возможно получение карбидов науглероживанием исключительно через газовую фазу. Для этого обычно используют металл и углеводород, в результате реакции получают карбид металла и водород. Газовая карбидизация металлов происходит при более высокой температуре.
Науглероживание окислов углеродсодержащими газами проводится редко.
Получение – карбид – кальций
| Дуговая печь для получения карбида кальция. |
Получение карбида кальция СаС2 проводят в специальной дуговой печи, которую можно изготовить в лаборатории.
Получение карбида кальция ( и других карбидов) можно проводить в графитовом тигле, который играет роль одного из полюсов. Другим полюсом служит графитовый стержень, вставленный в смесь окиси кальция с углем. Графитовый тигель для уменьшения теплоотдачи вставляют в шамотовый стакан или в тигель, который закрывают крышкой, имеющей отверстие для графитового стержня. Шамотовый стакан имеет внизу отверстие, через которое вводится электрический провод. Соединение тигля с проводом осуществляется через железный стакан, плотно надетый на тигель.
Получение карбида кальция ведется в электропечах, так как эта реакция эндотермична.
Получение карбида кальция и переработка его в ацетилен широко применяются в современной технике.
Для получения карбида кальция с высоким выходом ацетилена составляют шихту с большим содержанием антрацита и кокса, для получения более бедного карбида в шихту вводят большее количество извести.
Для получения карбида кальция служат специальные электропечи, в которых, при пропускании электрического тока через смесь извести и кокса, при температуре 1500 – 1600 получается карбид кальция в расплавленном состоянии. После затвердевания карбида кальция в изложницах его дробят, сортируют и герметически упаковывают в железные барабаны.
Для получения карбида кальция требуемого литража известь, антрацит и кокс должны содержаться в шихте в определенных соотношениях.
Способ получения карбида кальция за счет тепла сжигания кальция был предложен во время второй мировой войны
При получении карбида кальция реакция протекает между двумя твердыми фазами, поэтому для повышения однородности шихты и улучшения взаимодействия реагентов сырье перед загрузкой в печь дробят, отбирая после отсева куски определенных размеров ( известь 5 – 50 мм, углеродное сырье 2 – 30 мм в поперечнике); затем дробленые материалы смешивают в определенных количественных соотношениях. Размеры кусков шихты, равномерность их измельчения и качество смешения оказывают большое влияние на скорость и полноту взаимодействия реагентов.
Первые попытки1 получения карбида кальция сплавлением обожженной извести и угля в электрической дуге были сделаны еще в 1839 г., однако лишь в 1892 г. Муассан ( Франция) и Вильсон ( Канада) предложили конструкцию электродуговой печи, пригодной для промышленного использования.
Сырье для получения карбида кальция, а именно известь, кокс и антрацит, необходимо загружать в электропечь в виде смеси, в кусках определенной величины. Эту смесь, или, как ее называют, шихту, приготовляют в отделении дробления сырья.
Недавно процесс получения карбида кальция на базе кокса и извести значительно улучшен.
В процессе получения карбида кальция реакция происходит между двумя твердыми фазами, поэтому размеры кусков шихты, равномерность их измельчения и качество смешения оказывают большое влияние на скорость и полноту взаимодействия реагентов. На реакцию образования карбида кальция расходуется большое количество электрической энергии. Практический расход электрической энергии значительно превышает теоретический расход ( на 53 – 54 %) вследствие протекания побочных реакций – разложения карбида и остатков СаСО3 ( в извести), образования ферросилиция из примесей кремния и железа в шихте, а также вследствие значительных потерь тепла.
В процессе получения карбида кальция реакция происходит между двумя твердыми фазами, поэтому размеры кусков шихты, равномерность их измельчения и качество смешения оказывают большое влияние на скорость и полноту взаимодействия реагентов. На реакцию образования карбида кальция расходуется большое количество электрической энергии. Практический расход электрической энергии значительно превышает теоретический расход ( на 53 – 54 %) вследствие протекания побочных реакций – разложения карбида и остатков СаСОз ( в извести), образования ферросилиция из примесей кремния и железа в шихте, а также вследствие значительных потерь тепла.
Карбид кальция в сварке
Для сварочных работ карбид является чуть ли не идеальным веществом, потому что при взаимодействии с водой выделяет в окружающее пространство летучий газ ацетилен, который служит основой металлизации, напайки, кислородной сварки и множества иных процессов, относящихся к обработке металлических сплавов.
 Создается этот состав при очень высокой температуре (до 2400 градусов) посредством расплавления негашеной извести и кокса внутри электродуговой печки. Затем раскаленное жидкое вещество помещается в специальные формы (изложницы), где оно застывает и твердеет. Затем карбид раскалывают на кусочки размером не более 8 см. В итоге полученная субстанция будет состоять примерно на 78% из карбида кальция, а остальные 22% — это известковые окиси, примеси и иные вещества.
Создается этот состав при очень высокой температуре (до 2400 градусов) посредством расплавления негашеной извести и кокса внутри электродуговой печки. Затем раскаленное жидкое вещество помещается в специальные формы (изложницы), где оно застывает и твердеет. Затем карбид раскалывают на кусочки размером не более 8 см. В итоге полученная субстанция будет состоять примерно на 78% из карбида кальция, а остальные 22% — это известковые окиси, примеси и иные вещества.
Так как при воздействии воды карбид выделяет большое количество ацетиленового газа и тепловой энергии, это существенно затрудняет его хранение. Чтобы избежать порчи вещества, его нередко укладывают в герметичные стальные резервуары. При открытии этих металлических сосудов необходимо избегать открытого пламени и искр, иначе могут быть печальные последствия.
https://youtube.com/watch?v=QXp3OIBnSzk
Карбидная пыль (частички до 2 мм) непригодна для применения, потому что растворяется в воде практически моментально. Кроме того, при хранении большого количества пыли увеличивается риск, что применение состава в итоге приведет к взрыву резервуара. Специалисты отмечают, что килограмм рассматриваемого вещества способен выделить при взаимодействии с водой более 260 кубических дюймов ацетилена.
Как получают карбид?
Сначала о карбиде кальция. Его производство – дело востребованное. И хотя такие заводы требуют больших трат, особенно когда речь заходит об электроэнергии, предприятия от привычного способа изготовления не отказываются. Потому как спрос на такую продукцию не спешит падать. Ведь без ацетилена вряд ли можно представить хоть одну стройку. Чтобы экономить на электричестве, подобные предприятия открывают в странах с большим количеством ГЭС, в Канаде, например.
Почему же не перейти на работу с метаном, ведь из него тоже можно получить такой летучий газ? Да потому, что карбид кальция дает практически чистый продукт, довести до ума 98-ми процентный газ несложно. И перевозить его гораздо проще, чем тот, что получен при участии метана.
Главным объектом на таких производствах выступают электрические печи. В них загружают твердый уголь, который еще зовут коксом, и оксид кальция (известь, причем абы какая не подойдет, нужна очищенная и однородная). Все это раскаляется до 2-х тысяч градусов. И вуаля, реакция пошла.

Как результат жидкая субстанция, которая и станет потом привычным нам соединением. Но сначала ей нужно охладится в формах. После того, как градус снижен, эти пласты дробят на более удобные в использовании куски.
Теперь о кремниевом варианте. Получили его абсолютно случайно, как это по обыкновению бывает. Американский ученый пытался создать искусственный алмаз. В результате экспериментов произошло получение карбидов кремния (они, кстати, на втором месте по твёрдости после не ограненного бриллианта).
Он его запатентовал и открыл первый завод по производству материала. Сказать, что технология с тех пор сильно изменилась – нельзя. Разве что из нее исключили песок и соль, остался углерод и кремнезём, которые все так же накаляют до максимальных температур в печах.

Теперь о более затратных вариантах, к примеру, карбид вольфрама – покупка не из дешевых. Приготовьте около полутора тысяч рублей, с которыми придется распрощаться, приобретая 1000 граммов сырья.
Есть еще один «приятный» бонус, изготовитель может ограничить Вас в выборе количества приобретаемого товара, ведь многие указывают, что Вы обязаны купить минимум 10 килограммов. А если намерены приобрести состав с бором, то и того не легче – меньше 30-ти кило Вам вряд ли кто-то продаст, в то время как 1 кг. вылетит аж в 2 тысячи рублей.
Сварка карбидом
Сварка карбида, сделанного на основе кремния, подразумевает его непосредственный контакт с водой, в ходе которого выделяется значительное количество ацетиленового газа и много тепла. Из-за данной эксплуатационной характеристики обеспечить безопасное хранение данного материала не так-то просто. Для того чтобы это сделать, карбид кладут в абсолютно герметичные баки, выполненные из кровельного металла. В них должно помещаться от 100 до 130 кг.
При сварке карбидом выделяется большое количество ацетилена — газа, отличающегося быстрой воспламеняемостью, поэтому при открытии таких бидонов следует позаботиться, чтобы поблизости не было искр и открытого пламени.
Сварочные работы с использованием карбидной пыли с размером частиц 2 мм и менее производиться не будут, так как такая пыль практически моментально растворяется в воде. Если же добавить в воду слишком большое количество такой пыли, то существует реальная вероятность взрыва. Между прочим, килограмм карбида может привести к выделению почти целого кубометра чистого ацетилена.
Карбид весьма широко используется для сварки газового типа, а также для резки металлов. Когда ацетилен начинает гореть вместе с кислородом, температура пламени может достигать свыше 3000 градусов по Цельсию. Это позволяет применять данный материал даже при работе с тугоплавкими материалами.
Какие меры безопасности нужны при работе с карбидом?
Выше говорилось, что карбид является взрывоопасным веществом, поэтому следует соблюдать определенные правила, которые помогут не допустить получения травм:
- Это вещество практически моментально вступает во взаимодействие с воздухом и водой, причем результатом данной химической реакции будет горючий ацетилен. Вследствие такого свойства карбида для сварки его следует хранить в абсолютно сухой и герметичной таре.
- Взрывоопасен не только выделяющийся газ, но и сам карбид, поэтому поблизости него не должно находиться искр или открытого пламени.
- Карбидная пыль с размером частиц менее 2 мм при попадании на кожу и глаза может вызвать раздражение, поэтому работать с материалом следует в защитных перчатках и в очках.
- Постоянная сварка с использованием карбида производится только в специальном помещении, где отсутствуют горючие вещества, а все предметы, находящиеся там, должны быть абсолютно несгораемыми. Хранить оборудование следует в полностью изолированных отсеках помещения. В нем должна быть оборудована система принудительной вентиляции.
- Генераторы ацетилена, использующие в своей работе карбид, категорически запрещено размещать в подвальных помещениях.
- Когда работы, связанные с проведением сварки, будут завершены, все загруженное вещество нужно будет выработать. Отработанные шлаки (они, как правило, представляют собой известковый налет) удаляются в бункер или в иное специально отведенное под это место.
- Нельзя курить поблизости от проведения работ, рядом с самим карбидом — использование открытого огня разрешено на расстоянии не менее 10 метров.
- Когда осуществляется транспортировка или хранение баллонов с ацетиленом, на клапаны в обязательном порядке надеваются защитные колпачки, также во время перевозки нельзя допускать соударения баллонов или тем более их падения. Производить транспортировку вместе с другими веществами также запрещено.
Как правильно применять карбид для проведения сварных работ?
Технология использования этого материала представляет собой следующую последовательность действий:
- Его куски укладывают в корзину, причем их величина не должна превышать 8 см в диаметре, так как такой размер позволяет обеспечить выделение наибольшего количества ацетилена. Всю карбидную пыль предварительно удаляют, чтобы не допустить детонации материала во время работ.
- В аппарат, заполненный водой, устанавливают эту корзину, тщательно закрывая ее специальной крышкой, оснащенной винтом поперечной подачи.
- Начинают аккуратно вращать маховик винта, чтобы корзина постепенно опустилась в воду. Резкого погружения не допускают, так как это может привести к воспламенению газа и последующему взрыву. Карбид начнет постепенно реагировать с водой, выделяя значительные объемы ацетилена.
С того момента, как началось выделение ацетилена, можно приступать к проведению сварочных работ. Используют карбид для сварки стали, нержавеющих материалов, цветных металлов, а также разного рода заготовок, отличающихся достаточно высокой температурой плавления. В разобранном виде установка для ацетиленовой сварки является абсолютно безопасной. electrod.biz
Упаковка карбида кальция
При упаковке карбида кальция во влажной атмосфере в результате реакции с водой, содержащейся в воздухе, в барабане образуется некоторое количества ацетилена, поэтому открытие барабана следует производить медленно во избежание выброса карбидной пыли.
Например, барабан, в котором хранится 100 кг карбида кальция, имеет емкость около 80 л. Объем кусков карбида равен примерно 42 л. Следовательно, между кусками карбида кальция остается свободное пространство в 38 л, занятое газом. Если бы барабаны были совершенно герметичны и наполнялись в сухой атмосфере, то все свободное пространство было бы занято только воздухом, однако практически эти условия невыполнимы, и благодаря взаимодействию с влагой, содержащейся в воздухе, небольшое количество ацетилена всегда будет образовываться в барабане. Достаточно примерно 1 л ацетилена в воздухе, заполняющем свободное пространство барабана, чтобы ацетилено-воздушная смесь могла вспыхнуть от искры.
Во время наполнения барабана в сырой атмосфере получение такой смеси может произойти очень быстро. При закупорке барабанов с неостывшим карбидом кальция происходит частичное поглощение азота, вследствие чего повышается содержание кислорода в воздухе, присутствующем в барабане. В ходе практических исследований установлено, что в некоторых случаях находящийся в них воздух содержал до 26% кислорода, что значительно повышает взрывоопасность ацетилено-воздушной смеси.
Также опасность представляет наличие в карбиде кальция ферросилиция. Удар стальным зубилом по ферросилицию и даже удар друг о друга кусков ферросилиция являются источником образования искры и, как следствие, оказаться причиной взрыва.
Присутствие ферросилиция объясняется наличием загрязняющих примесей в исходном сырье для получения карбида кальция (железа в коксе и кремнокислоты в извести), а также переходом в шихту железа, из которого изготовлен кожух электрода и др.
Очистку карбида кальция от ферросилиция осуществляют при помощи специальных электромагнитных сепараторов. Данный способ не гарантирует полную очистку поскольку куски ферросилиция, находящиеся внутри больших кусков карбида кальция, остаются неизвлечёнными, а затем, находясь уже в барабане, освобождаются от обволакивающей их оболочки карбида кальция. Необходимо учитывать, что ферросилиций, содержащий более 30% кремния, не обладает магнитными свойствами.
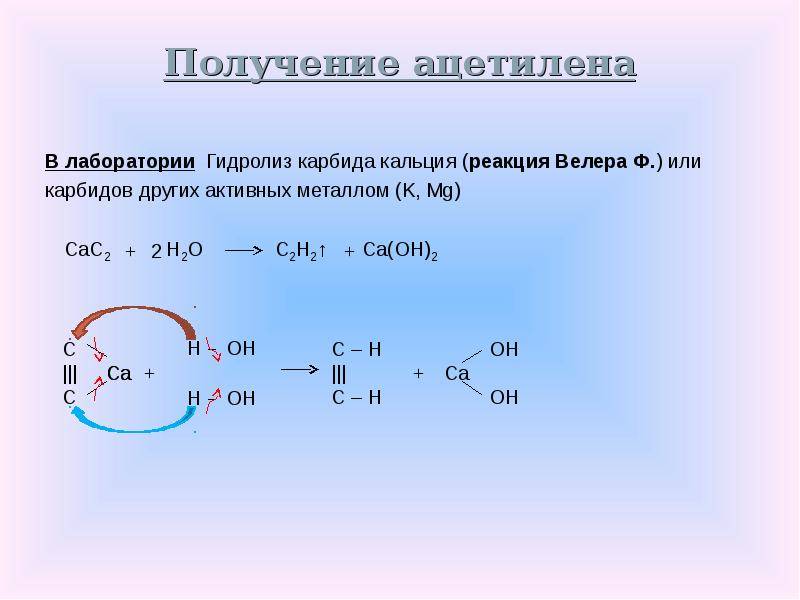
Лабораторный опыт получения ацетилена
Многим из школьных уроков химии знакома реакция взаимодействия карбида с водой. Обычно этот опыт позволяет продемонстрировать реакцию получения ацетилена, а также физические и химические его свойства. Процесс выделения газа при этом происходит достаточно бурно, поэтому трубка, отводящая ацетилен из колбы с действующими веществами, помещается в чашу с водой. Это обеспечивает менее активное и стремительное движение газа. Кроме того, в лабораторных условиях можно использовать и другой способ, чтобы сделать не слишком бурной реакцию разложения такого соединения, как карбид. Ацетилен при этом идет равномерно и спокойно. Для этого вместо воды необходимо взять насыщенный раствор поваренной соли
Также в лаборатории при проведении этой реакции следует осторожно добавлять воду в карбид, помещенный в объемную колбу, а не наоборот
Что такое «карбид», знает любой мальчишка. Если бросить кусочек карбида в лужу, то кроме дикого шипения получается еще дичайшая вонь. А как получается сам карбид?
Вообще карбидов существует множество, как и применений ему. Но нас пока интересует карбид кальция CaC 2 — то есть тот, который используют для получения ацетилена при соединении карбида с водой.
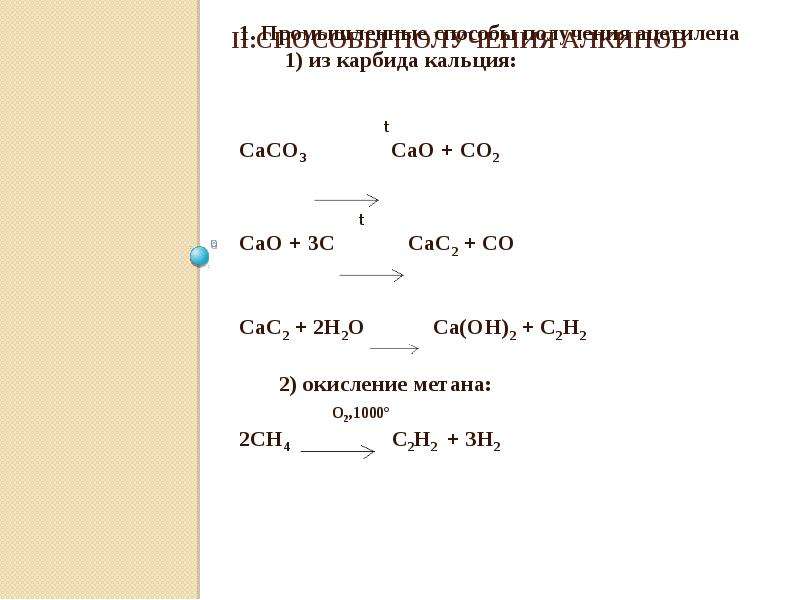
Слишком сложного в получении карбида кальция нет. Сейчас для этого в электропечах пережигают негашеную известь с коксом. При всей этой простоте — впервые карбид кальция был получен в лаборатории в 1836-м году, а промышленно его начали получать в 1892 году. Для попаданца — широчайшее поле для внедрения!
Все реакция — CaO + 3C = CaC 2 + CO Негашеная известь соединяется с углеродом. Негашеную известь получали с древних времен, пережигая известняк, ну и древесный уголь тоже дефицитом не был никогда. Полученный попутно угарный газ (СО) окисляется до углекислого газа прямо при выходе из печи, хотя сейчас часто печи делают закрытыми для сбора угарного газа. На 100 весовых частей негашеной извести нужно 70-80 весовых частей углерода. При производстве лучше иметь избыток угля, чем извести — такой карбид отдает больше ацетилена. Готовый карбид кальция технического качества почти на 80% состоит из самого карбида кальция, 17% — известь, остальное примеси. Карбид выходит в виде расплава, который после затвердевания измельчают.
Но, несмотря на простоту реакции получения, есть некоторые неприятные нюансы. Главное — процесс этот эндотермический, он поглощает дикое количество тепла в процессе производства — 3000 кВт на тонну продукта. Именно из-за этого его делают электродуговым способом. При этом сам процесс идет в жидкой фазе — то есть расплавленная известь постепенно реагирует с кусками углерода. При этом нужна температура примерно 2000°С, что совсем немало. И что совсем неприятно — при перегреве до 2200-2400°С карбид кальция распадается на составляющие.
Поэтому, если нам не доступно электричество в больших объемах, у нас есть два выхода.
Первый — это плавить в тигле. Проблема в том, что тигель должен выдержать эти самые 2000°С, а в древние времена ни графитовый, ни вольфрамовый тигель нам будут недоступны.
Второй — построить небольшую доменную печь. Требуемое тепло даст избыточное количество угля. Уголь и известь насыпаются туда слоями и печь поддувается большим количеством воздуха. Такие печи пытались строить и главная проблема — поддержка точных условий реакции, что регулируется силой поддува. С одной стороны — такую печь можно построить только когда уже работают доменные печи для железа. А с другой стороны — а нам точно нужен карбид, если нет даже железа?
Трудность вызовет хранение карбида. Он должен быть абсолютно изолирован от воды — много лучше, чем порох. Потому что если порох намокнет, то он не взорвется, а если намокнет карбид — то взрыв обеспечено. И что хуже всего — при хранении не должна использоваться медь, серебро или золото.
Проблем с производством карбида будет немало. Но при каком производстве их будет мало? Зато все проблемы — решаемые чуть ли не с технологиями Древнего Египта. А пользы от карбида будет много…
И последнее — ацетилен, который получается после контакта карбида с водой — ничем не пахнет, человек просто не имеет обонятельных рецепторов для него. Та вонь, по которой мы безошибочно определяем карбид — это примеси, которых в техническом карбиде несколько процентов.