Область применения
Первое – изготовление водопроводов и предметов быта, к счастью, относится к довольно давним временам. На сегодня в жилище металл попадает только с защитным слоем и при условии отсутствия контактов с пищей, водой и человеком.
- А вот использование свинца для сплавов и в качестве припоя началось еще на заре цивилизации и продолжается до сих пор.
- Свинец – металл стратегического значения, особенно с тех пор, как из него стали отливать пули. Боеприпас для стрелкового и спортивного оружия и сейчас изготавливается только из свинца. А его соединения применяются в качестве взрывчатых веществ.
- 75% производимого в мире металла используется для производства свинцовых аккумуляторов. Вещество продолжает оставаться одним из главных элементов химических источников тока.
- Коррозийная устойчивость металла эксплуатируется при изготовлении кислотоупорной аппаратуры, трубопроводов, а также защитных оболочек для силовых кабелей.
- Ну и, конечно, свинец применяют при оборудовании рентген-кабинетов: облицовка стен, потолка, пола, защитные перегородки, защитные костюмы – все изготавливается с участием свинца. На испытательных полигонах, в том числе и ядерных, металл незаменим.
Стоимость металлов определяется на нескольких биржах мирового значения. Наиболее известной является Лондонская биржа металлов. Стоимость свинца в октябре 2016 года составляет 2087,25 $ за тонну.
Свинец – металл, очень востребованный в современной промышленности. Некоторые его качества – коррозионная стойкость, способность поглощать жесткое излучение, совершенно уникальны и делают металл незаменимым несмотря на его высокую токсичность.
Данное видео расскажет, что будет если вылить свинец в воду:
СВИНЕЦ, Pb (лат. plumbum * а. lead, plumbum; н. Blei; ф. plomb; и. plomo), — химический элемент IV группы периодической системы Менделеева , атомный номер 82, атомная масса 207,2. Природный свинец представлен четырьмя стабильными 204 Pb (1,48%), 206 Pb (23,6%), 207 Pb (22,6%) и 208 Pb (52,3%) и четырьмя радиоактивными 210 Pb, 211 Pb, 212 Pb и 214 Pb изотопами; кроме того, получено более десяти искусственных радиоактивных изотопов свинца. Известен с древних времён.
Методы избавления от оксида
Во время взаимодействия с воздухом между атомами металла и окружающей средой образуется ионная связь. Кислород отдает два электрона. На поверхности быстро возникает окислительный слой. Такая оксидная пленка способна предотвратить дальнейшее воздействие враждебной среды. Пленка, также становится барьером во время передачи электричества.
Оксидная пленка на продукте, изготовленном из свинца появляется через малый промежуток времени. Механическая очистка – довольно трудоемкое и бесполезное занятие. Сразу после успешного снятия слоя, образуя поле, и оголенные атомы вступают в связь с новыми атомами воздуха. Создать защиту для предмета можно при использовании масла подсолнуха. Также актуален вариант с графитовой смазкой и лаком.
Для домашнего обихода отлично подходит масло подсолнуха. Масло наливают в миску, после чего в жидкость помещают требуемое изделие из свинца. При правильной выдержки (около 5 минут), необходимо вытянуть изделие из масла и дать ему просохнуть на подготовленных салфетках.
В условиях производства для уменьшения распространения оксидных включений на поверхности деталей применяют графитовую смазку. Смазка не является редкой или дорогостоящей, однако в бытовых условиях она редко оказывается в наличии. Такое средство продается в автомагазинах и хозяйственных торговых точках. При должном отношении свинцовая поверхность будет длительное время демонстрировать блеск.

Графитовая смазка для свинца
Если оксидная пленка уже успешно покрыла поверхность, существуют способы ее удаления. Для этого, применяется концентрированный раствор кислоты. Для таких действий необходима специальная подготовка, включая наличие химического стеклянного инвентаря. Обычные столовые банки или миски не подойдут. Реактивные ингредиенты могут нанести вред человеку, оставить ожоги на теле.
Приветствуется использование защитных очков и маски.
Обрабатываемое изделие погружается в кислотный раствор. Необходимо подождать пока пленка оксида будет разрушена. После успешного подъема из раствора обрабатывается поверхность для защиты маслом или лаком.
Нахождение в природе
Содержание в земной коре — 1,6·10−3 % по массе. Самородный свинец встречается редко, круг пород, в которых он установлен, достаточно широк: от осадочных пород до ультраосновных интрузивных пород. В этих образованиях он часто образует интерметаллические соединения (например, звягинцевит (Pd,Pt)3(Pb,Sn) и др.) и сплавы с другими элементами (например, (Pb + Sn + Sb)). Он входит в состав 80 различных минералов. Важнейшие из них: галенит PbS, церуссит PbCO3, англезит PbSO4 (сульфат свинца); из более сложных — тиллит PbSnS2 и бетехтинит Pb2(Cu,Fe)21S15, а также сульфосоли свинца — джемсонит FePb4Sn6S14, буланжерит Pb5Sb4S11. Всегда содержится в рудах урана и тория, имея часто радиогенную природу. В природных условиях часто образует крупные залежи свинцово-цинковых или полиметаллических руд стратиформного типа (Холоднинское, Забайкалье), а также скарнового (Дальнегорское (бывшее Тетюхинское), Приморье; Брокен-Хилл в Австралии) типа; галенит часто встречается и в месторождениях других металлов: колчеданно-полиметаллических (Южный и Средний Урал), медно-никелевых (Норильск), урановых (Казахстан), золоторудных и др. Сульфосоли обычно встречаются в низкотемпературных гидротермальных месторождениях с сурьмой, мышьяком, а также в золоторудных месторождениях (Дарасун, Забайкалье). Минералы свинца сульфидного типа имеют гидротермальный генезис, минералы окисного типа часты в корах выветривания (зонах окисления) свинцово-цинковых месторождений. В кларковых концентрациях свинец входит практически во все породы. Единственное место на земле, где в породах больше свинца по сравнению с ураном — Кохистанско-Ладакхская дуга на севере Пакистана.

Галенит, Дальнегорское скарновое месторождение
В таблице приведены некоторые параметры распространённости свинца в природных условиях по А. П. Виноградову:
| Породы | Каменные метеориты | Дуниты и др. | Базальты и др. | Диориты и др. | Граниты и др. | Глины и др. | Земная кора |
| Содержание, масс.% | 0000002×10−5 | 0001×10−5 | 0008×10−4 | 0001,5×10−3 | 0002×10−3 | 0002×10−3 | 1,6×10−3 |
| Объекты | Живое вещество Земли | Литосфера | Почва0 | Растения (в золе) | Вода океанов (мг/л) |
| Содержание, масс.% | 000000005×10−5 | 000,0016 | 00,001 | 000000,001 | 0000000,00003 |
Обобщённые концентрации элементов в минералах приведены в таблице, в скобках — количества минералов, по которым рассчитаны средние содержания компонентов.
| Минерал | Свинец (общ) | Уран | Торий |
| 00Настуран | 04,750 (308) | 58,87 (242) | 2,264 (108) |
| 00Монацит | 00,6134 (143) | 0,2619 (160) | 6,567 (150) |
| 000Ортит | 00,0907 (90) | 0,1154 (88) | 6,197 (88) |
| 000Циркон | 00,0293 (203) | 0,1012 (290) | 0,1471 (194) |
| Сфен (Титанит) | 00,0158 (12) | 0,0511 (14) | 0,0295 (21) |
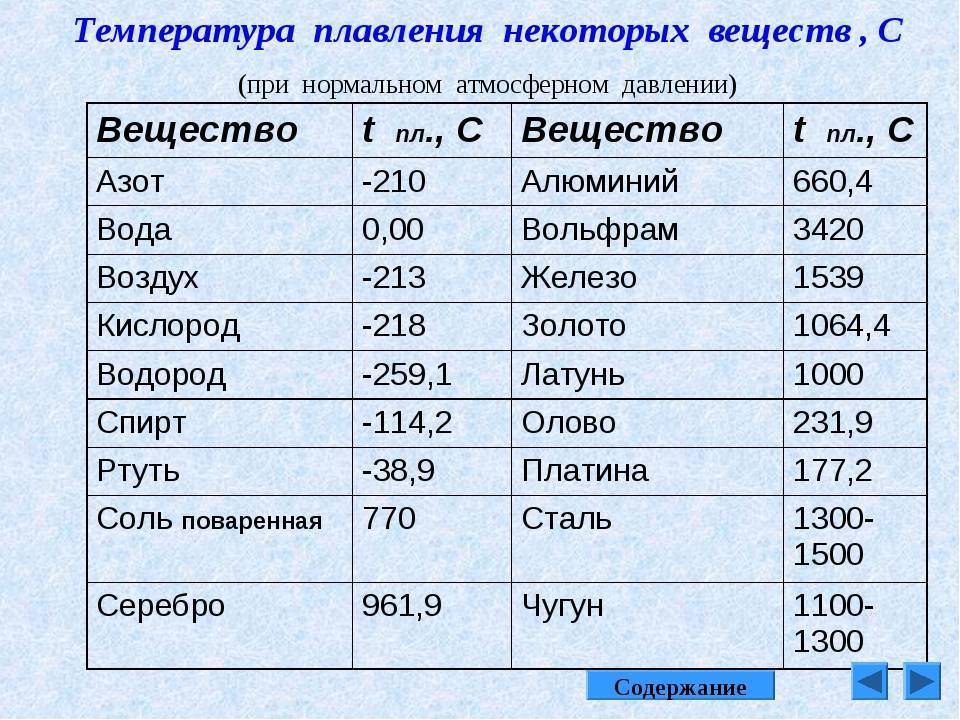
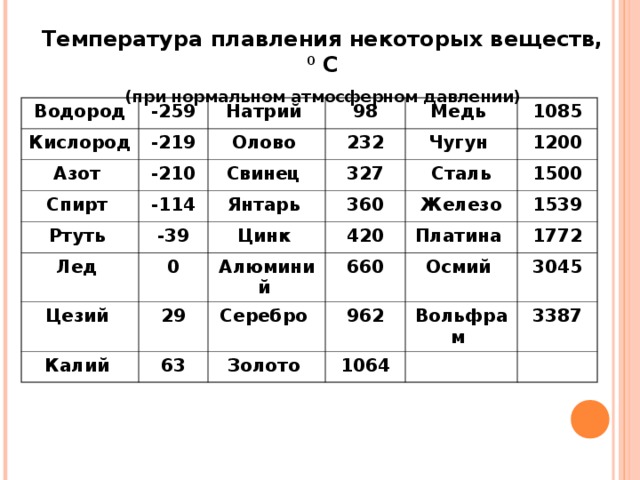
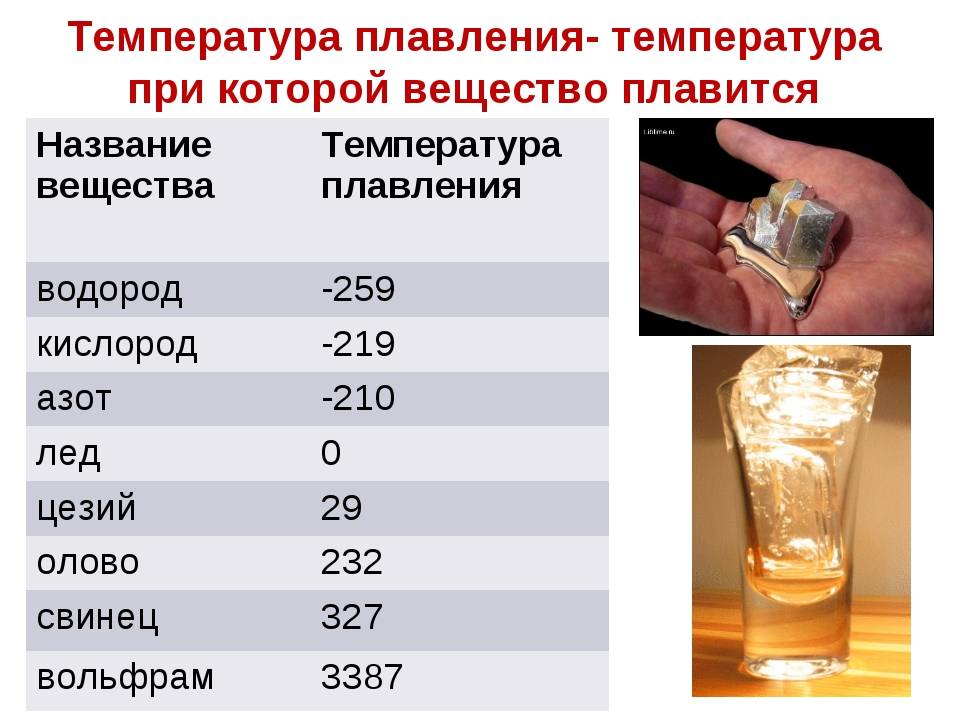
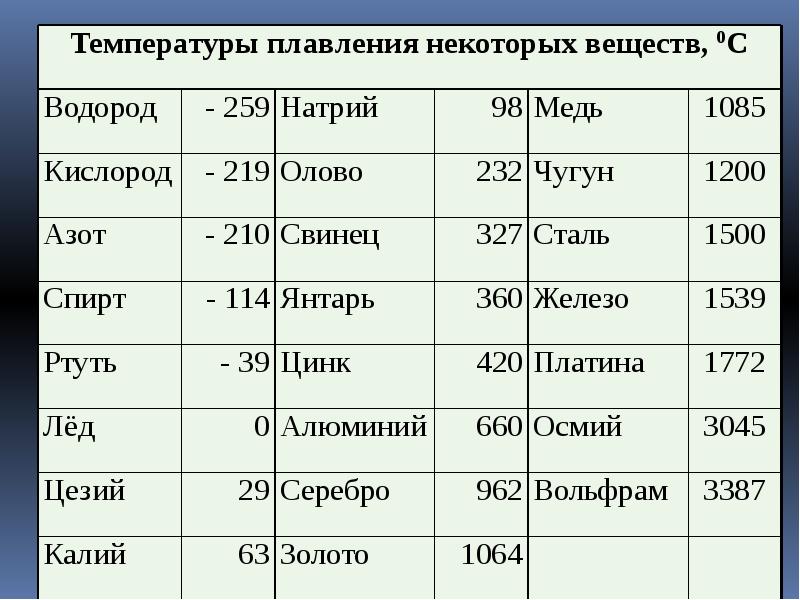
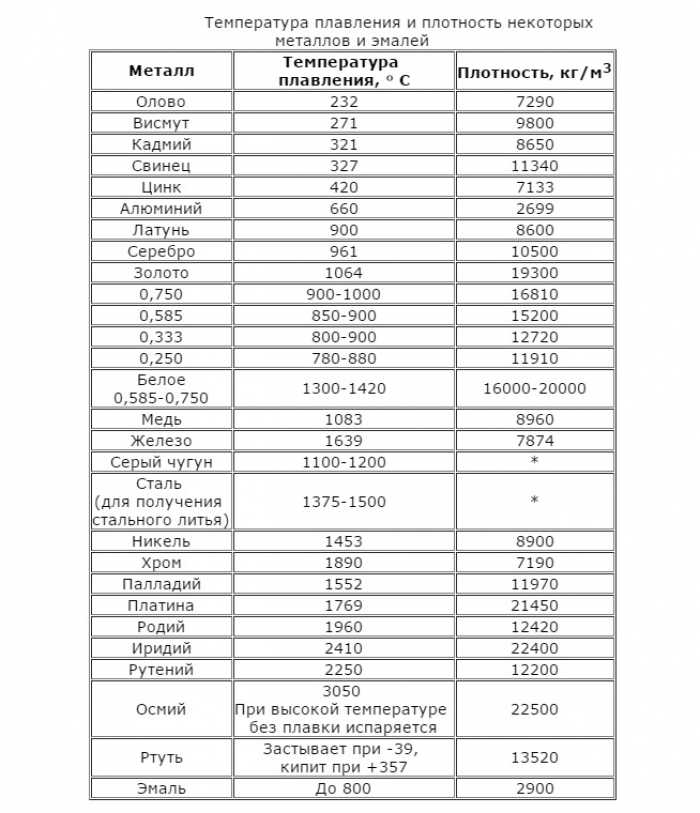
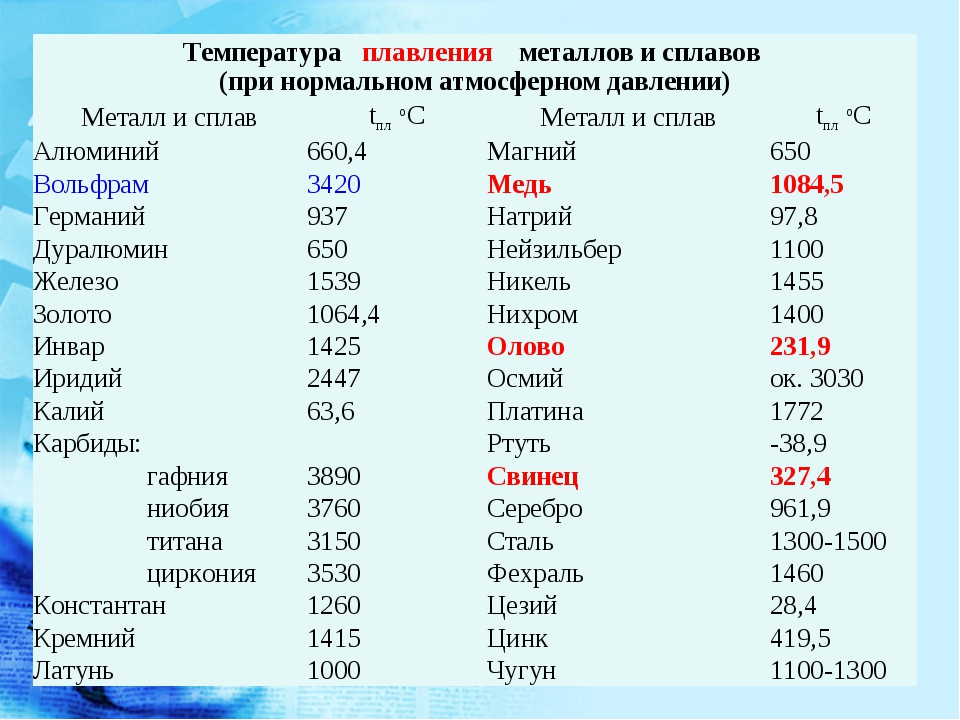
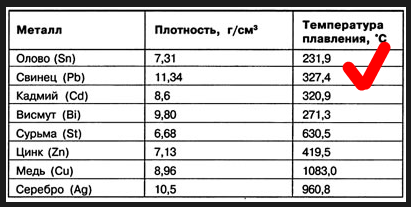
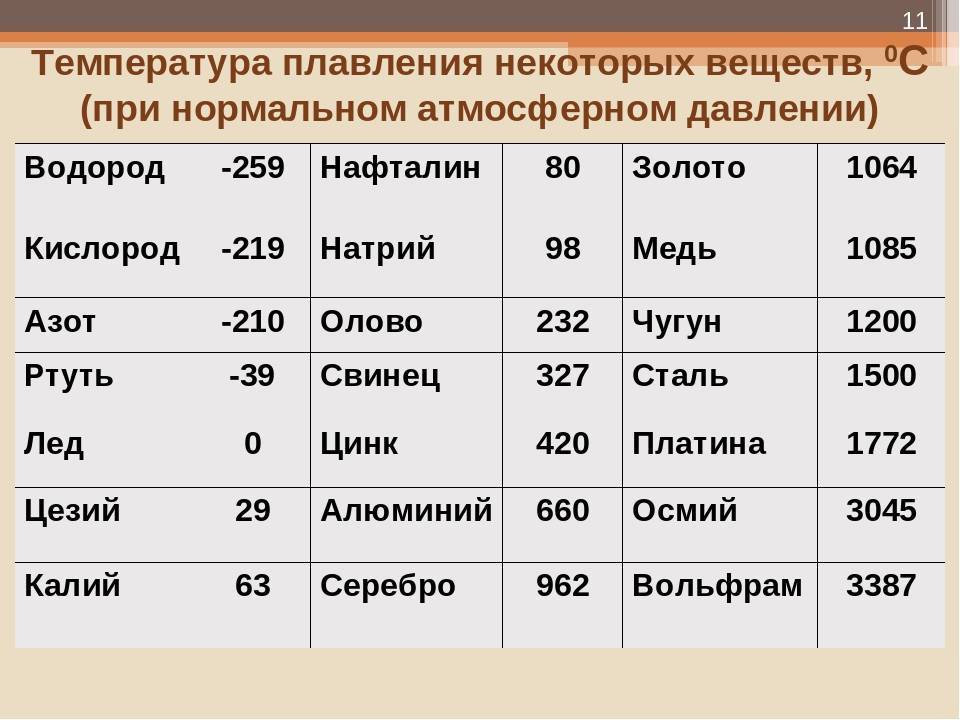
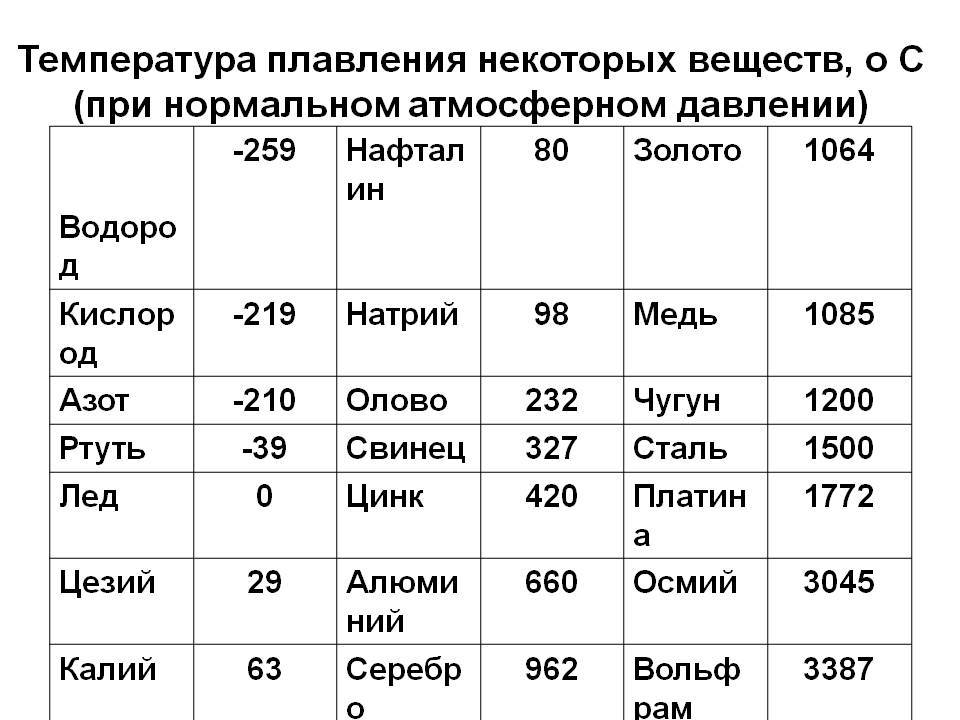
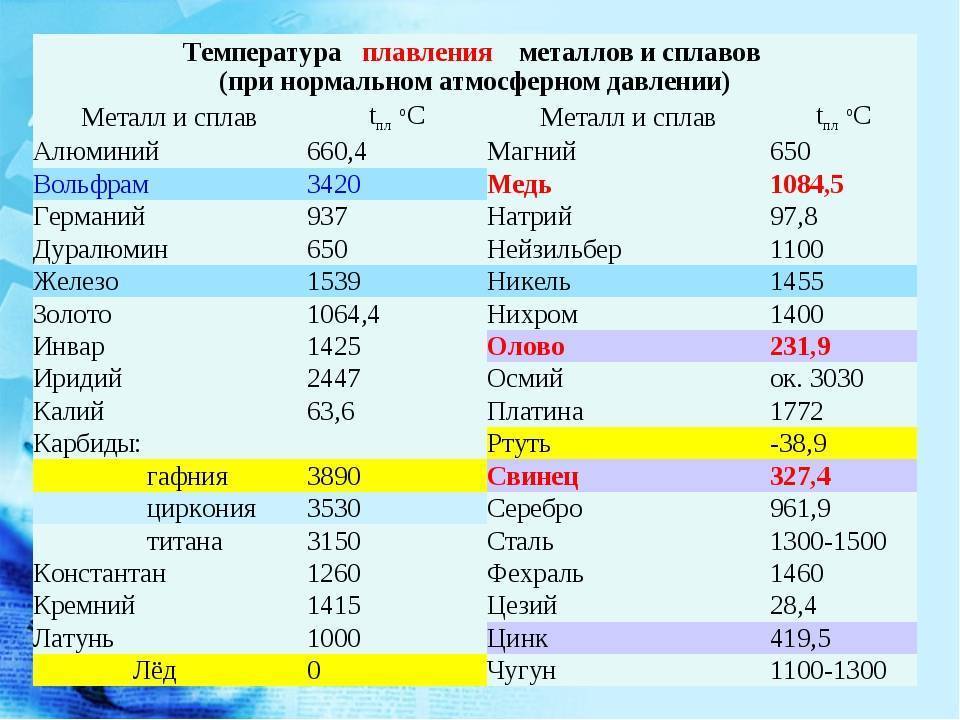
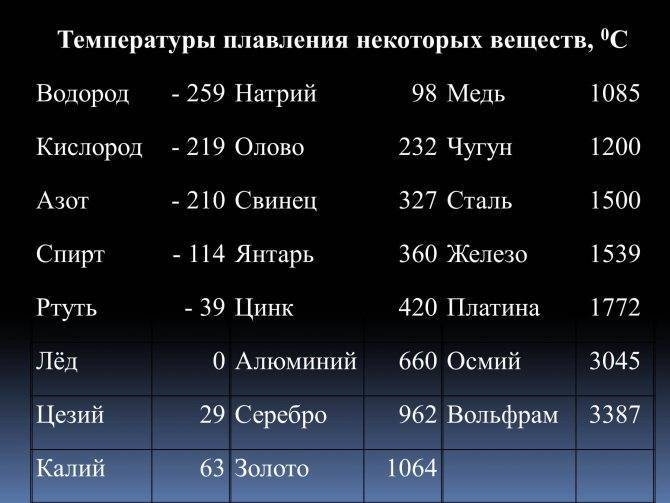
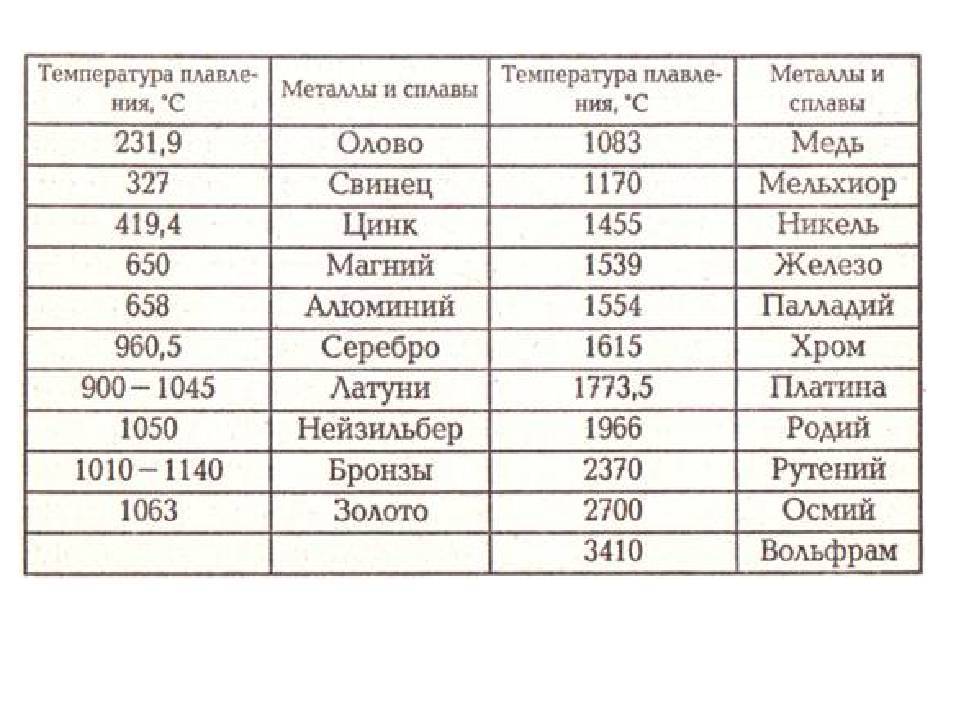
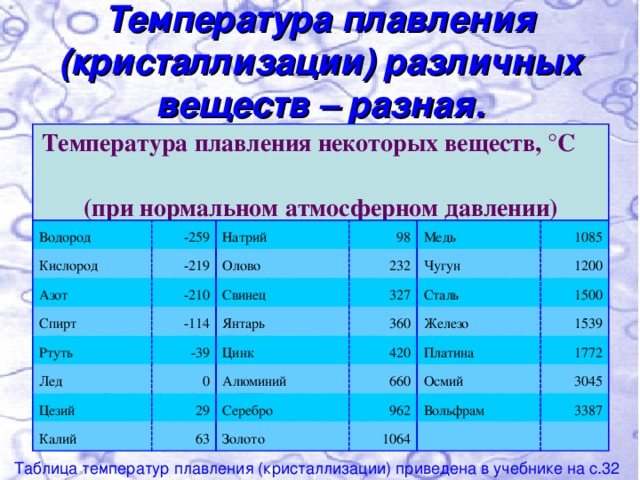
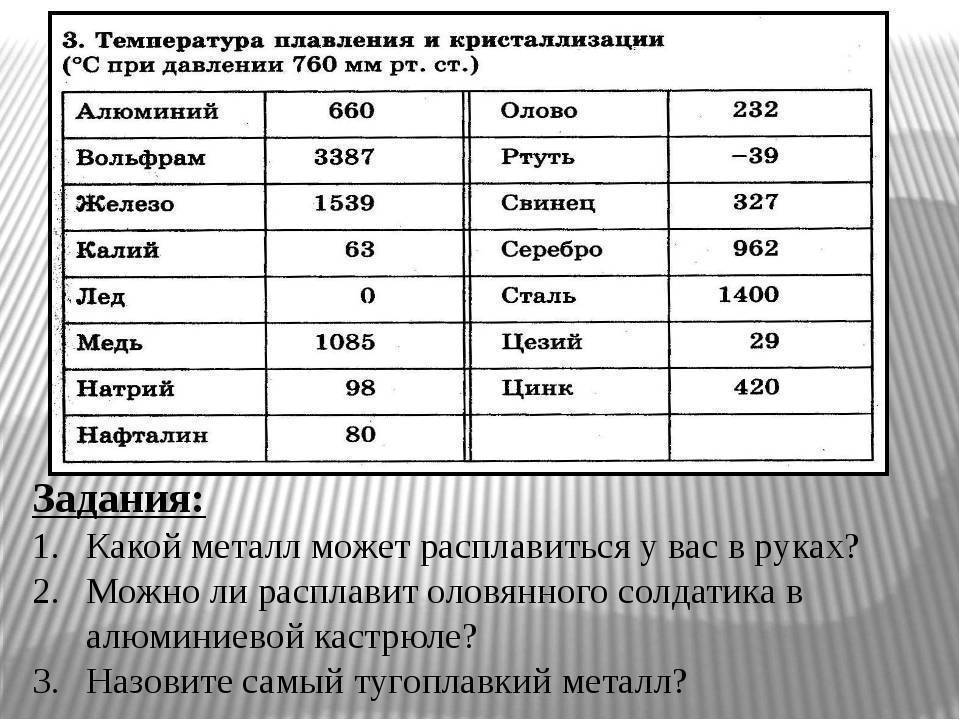
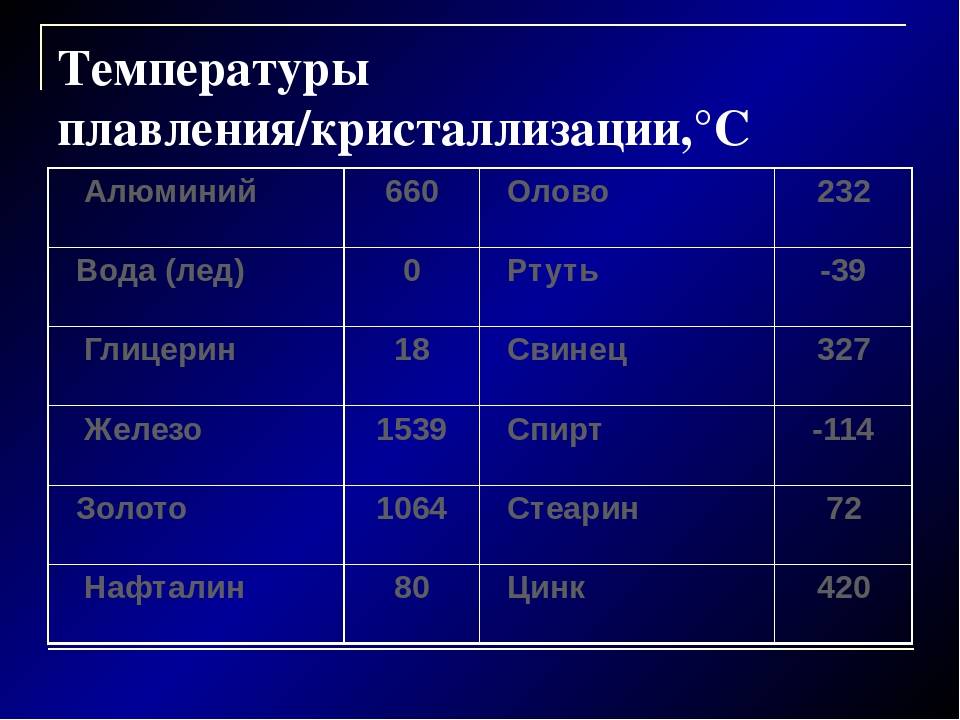
Свойства свинца (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Свинец |
| 102 | Прежнее название | |
| 103 | Латинское название | Plumbum |
| 104 | Английское название | Lead |
| 105 | Символ | Pb |
| 106 | Атомный номер (номер в таблице) | 82 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, тяжёлый, цветной металл |
| 109 | Открыт | Известен с глубокой древности. |
| 110 | Год открытия | 7000 до н. э. |
| 111 | Внешний вид и пр. | Ковкий, сравнительно легкоплавкий, тяжёлый металл серебристо-белого цвета с синеватым отливом |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00099 % |
| 120 | Содержание в морях и океанах (по массе) | 3,0·10-9 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1,0·10-6 % |
| 122 | Содержание в Солнце (по массе) | 1,0·10-6 % |
| 123 | Содержание в метеоритах (по массе) | 0,00014 % |
| 124 | Содержание в организме человека (по массе) | 0,00017 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 207,2(1) а. е. м. (г/моль) |
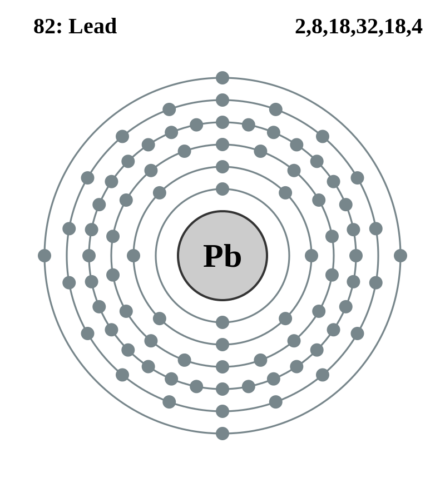
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p2 |
| 203 | Электронная оболочка | K2 L8 M18 N32 O18 P4 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 154 пм |
| 205 | Эмпирический радиус атома* | 180 пм |
| 206 | Ковалентный радиус* | 146 пм |
| 207 | Радиус иона (кристаллический) | Pb2+ 112 (4) пм, 133 (6) пм, 143 (8) пм, 163 (12) пм, Pb4+ 79 (4) пм, 91,5 (6) пм, 108 (8) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 202 пм |
| 209 | Электроны, Протоны, Нейтроны | 82 электрона, 82 протона, 125 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 14-ая группа (по старой классификации – главная подгруппа 4-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, -1, 0, +1, +2, +3, +4 |
| 302 | Валентность | II, IV |
| 303 | Электроотрицательность | 2,33 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 715,6 кДж/моль (7,4166799(6) эВ) |
| 305 | Электродный потенциал | Pb2+ + 2e– → Pb, Eo = -0,126 В, Pb4+ + 4e– → Pb, Eo = +0,77 В, Pb4+ + 2e– → Pb2+, Eo = +1,694 В |
| 306 | Энергия сродства атома к электрону | 35,1 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 11,34 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 10,66 г/см3 (при температуре плавления 327,46 °C и иных стандартных условиях, состояние вещества – жидкость) |
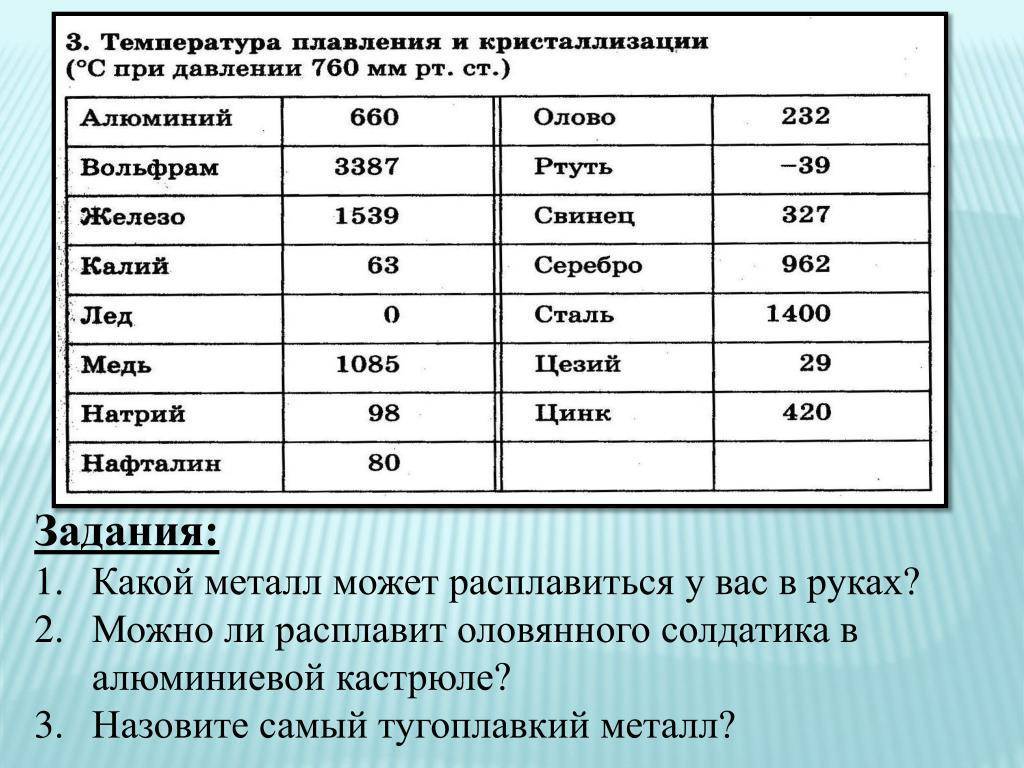
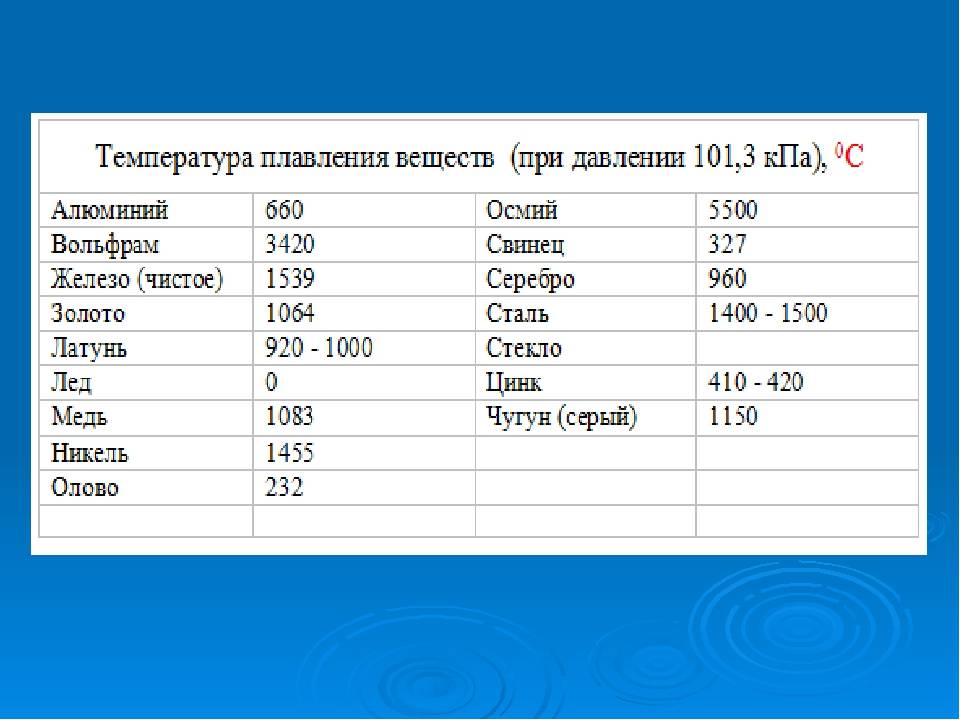
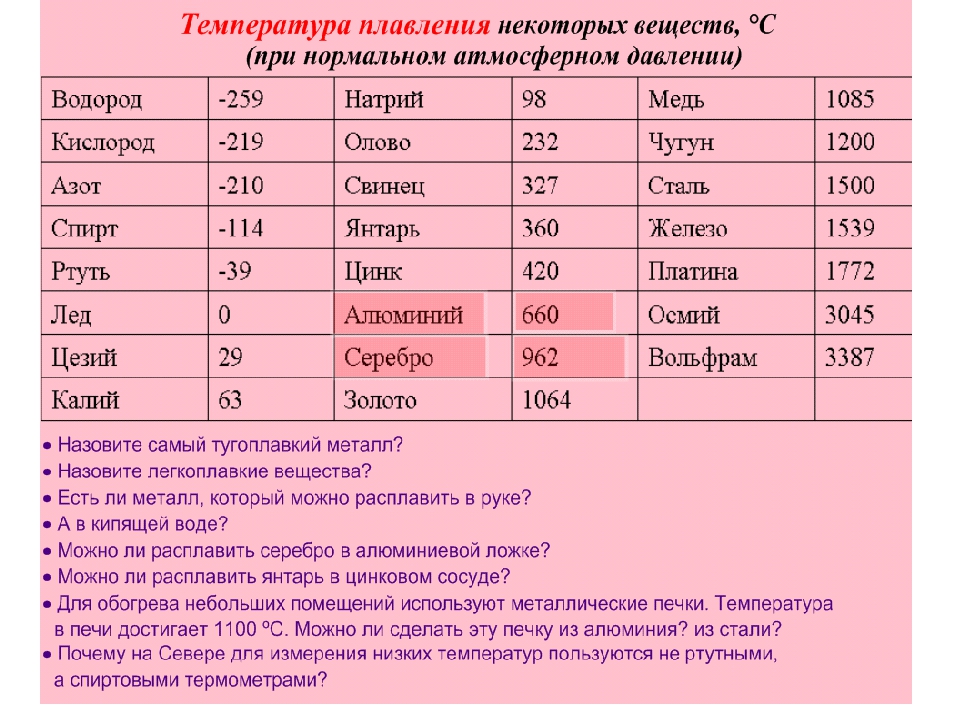
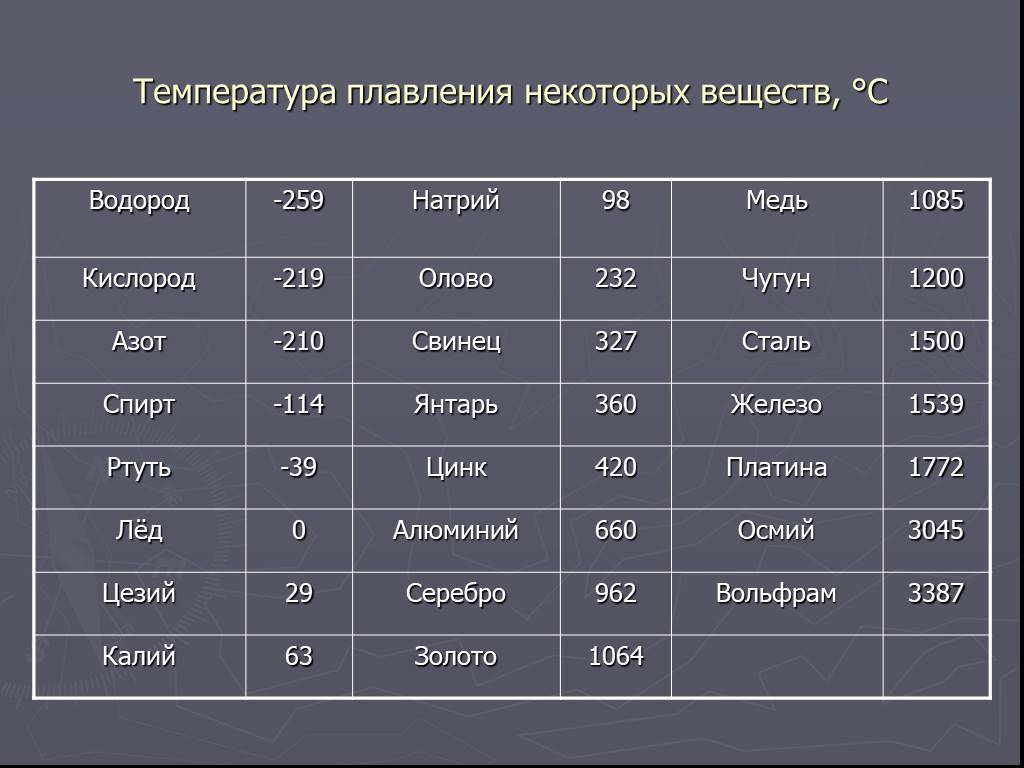
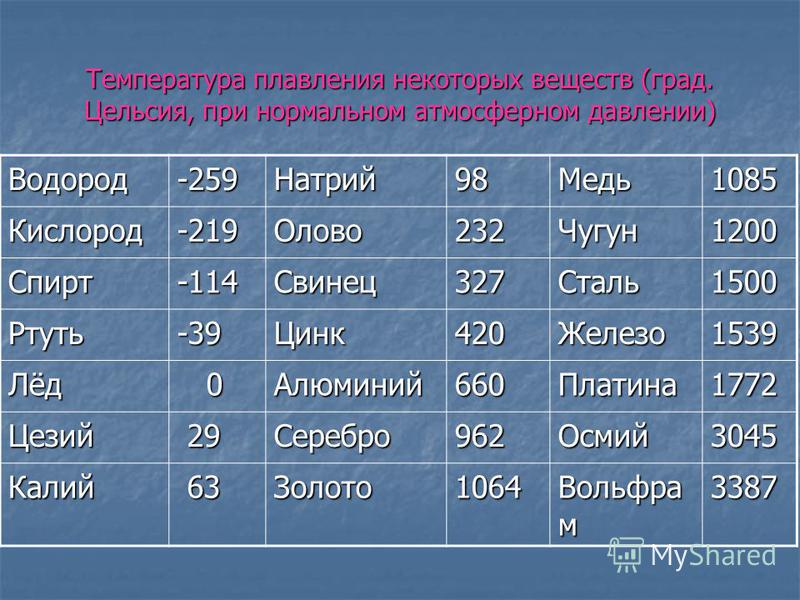
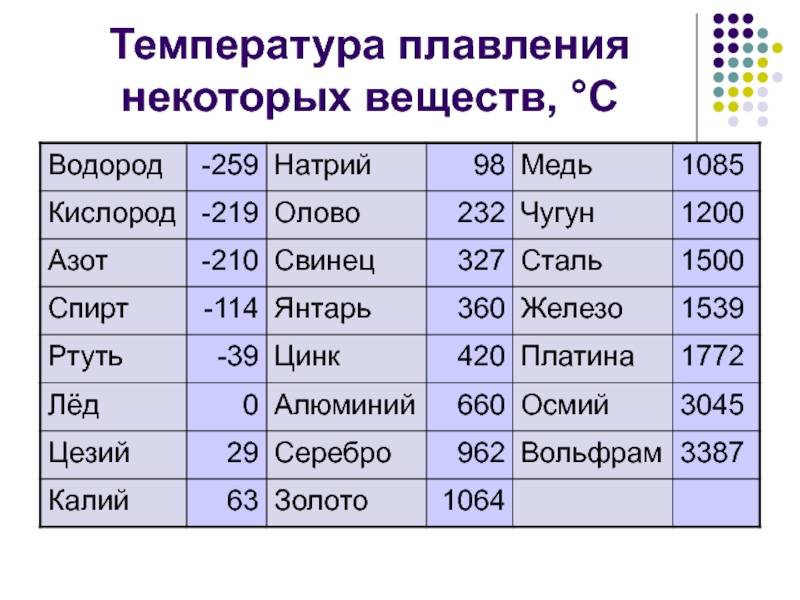
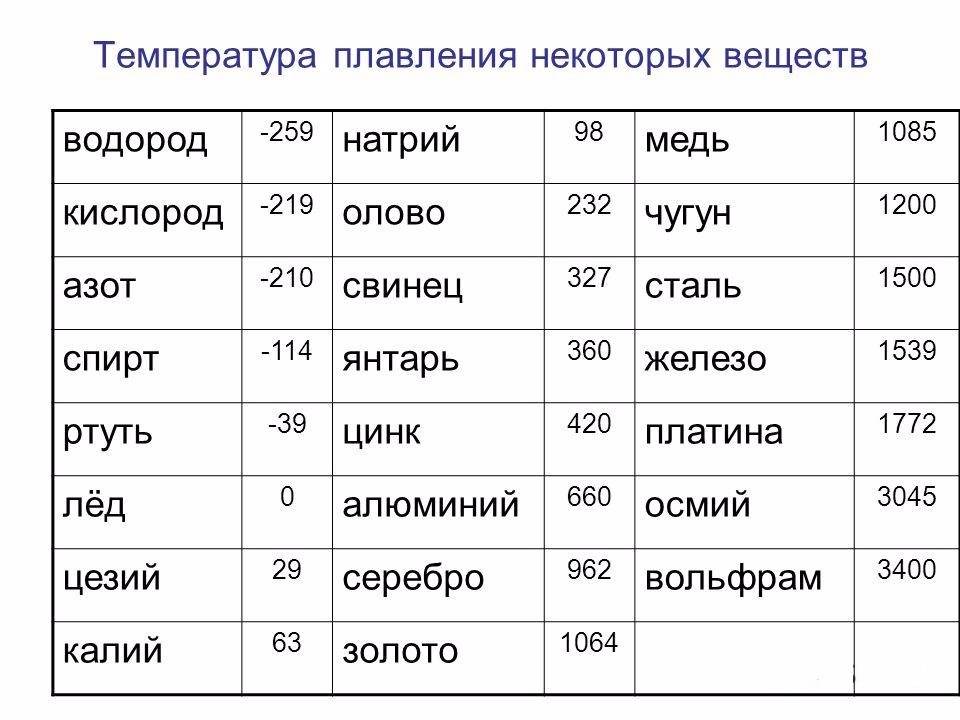
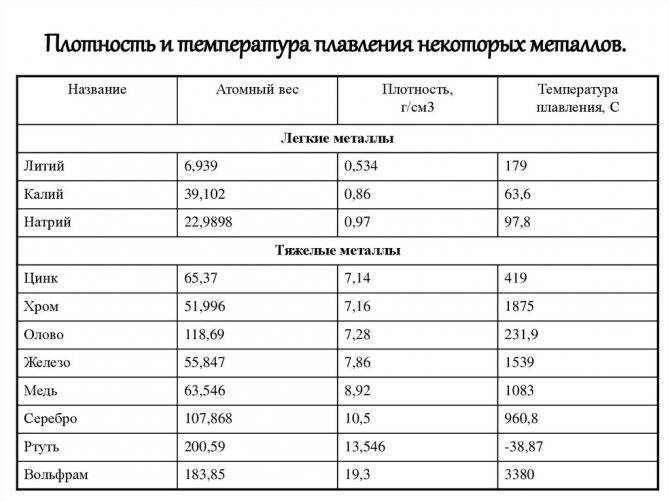
| 402 | Температура плавления* | 327,46 °C (600,61 K, 621,43 °F) |
| 403 | Температура кипения* | 1749 °C (2022 K, 3180 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл) | 4,77 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 179,5 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 26,65 Дж/(K·моль) |
| 411 | Молярный объём | 18,3 см³/моль |
| 412 | Теплопроводность | 35,3 Вт/(м·К) (при стандартных условиях), 35,3 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
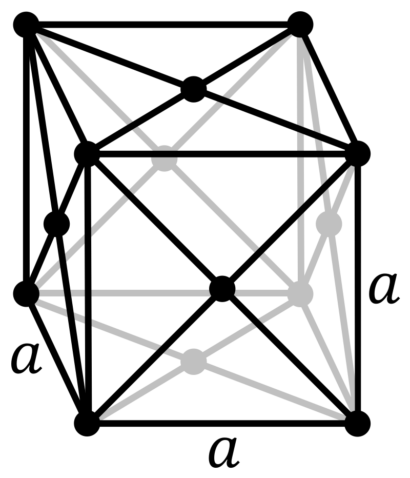
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | 4,950 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 88 K |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-92-1 |
Примечание:
205* Эмпирический радиус атома свинца согласно и составляет 175 пм.
206* Ковалентный радиус свинца согласно и составляет 146±5 пм и 147 пм соответственно.
401* Плотность свинца согласно и составляет 11,3415 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 11,336 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно, а также 10,686 г/см3 (при 327,4 °C и иных стандартных условиях, состояние вещества – жидкость).
402* Температура плавления свинца согласно составляет 327,4 °C (600,55 K, 621,32 °F).
403* Температура кипения свинца согласно составляет 1745 °C (2018,15 К, 3173 °F).
408* Удельная теплота испарения (энтальпия кипения ΔHкип) свинца согласно и составляет 177,8 кДж/моль и 177,7 кДж/моль соответственно.
ПРИМЕНЕНИЕ

Нитрат свинца применяется для производства мощных смесевых взрывчатых веществ. Азид свинца применяется как наиболее широко употребляемый детонатор (инициирующее взрывчатое вещество). Перхлорат свинца используется для приготовления тяжёлой жидкости (плотность 2,6 г/см³), используемой во флотационном обогащении руд, он иногда применяется в мощных смесевых взрывчатых веществах как окислитель. Фторид свинца самостоятельно, а также совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока.
Висмутат свинца, сульфид свинца PbS, иодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях. Хлорид свинца PbCl2 в качестве катодного материала в резервных источниках тока. Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с. 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников. Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но и также на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и другие.
Свинцовые белила, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, — получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода H2S. Свинцовые белила применяют также для производства шпатлёвки, в технологии цемента и свинцовокарбонатной бумаги.
Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика).
Борат свинца Pb(BO2)2•H2O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора.
Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония NH4Cl. Его применяют для приготовления мазей при обработке опухолей.
Хромат свинца PbCrO4 известен как хромовый жёлтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве жёлтых пигментов.
Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке.
Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах.
Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85—90 % Sn и 15—10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Было время, когда на оболочки кабелей шла значительная часть производимого в мире свинца, благодаря хорошим влагозащитным свойствам таких изделий. Однако впоследствии свинец в существенной мере вытеснили из этой области алюминий и полимеры. Так, в странах Запада использование свинца на оболочки кабелей упало с 342 тысяч тонн в 1976 году до 51 тысяч тонн в 2002 году. Соединения свинца используются в производстве красителей, красок, инсектицидов, стеклянных изделий и как добавки к бензину в виде тетраэтилсвинца (C2H5)4Pb (умеренно летучая жидкость, пары которой в малых концентрациях имеют сладковатый фруктовый запах, в больших — неприятный запах; Тпл = 130 °C, Ткип = +80 °С/13 мм рт. ст.; плотность 1,650 г/см³; nD2v = 1,5198; не растворяется в воде, смешивается с органическими растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
Используется для защиты пациентов от излучения рентгеновских аппаратов.
Свинец (англ. Lead) — Pb
| Молекулярный вес | 207.20 г/моль |
| Происхождение названия | от латинского plumbum |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
Общие свойства олова
Все свойства этого металла можно разделить на две большие группы: физические и химические.
Физические характеристики
Это серебристый ковкий металл, который легко окисляется при температуре окружающей среды, при этом цвет олова изменяется на темно-серый. Если согнуть пластину из этого металла, то можно услышать характерный звук, так называемый «крик олова», который возникает из-за трения между составляющими его кристаллами. Одной из ярко выраженных его характеристик является резкое ухудшение механических свойств при определенных условиях, носящее название «оловянная чума»: ниже температуры -18 °C происходит разрушение металла, и он начинает выглядеть, как серый порошок.
Чистое олово имеет две аллотропных модификации: серую и белую. Серая модификация имеет кубическую кристаллическую структуру, является полупроводником, очень хрупкая, имеет низкую плотность и стабильна при температуре ниже 13,2 °C. Белая аллотропная модификация имеет тетрагональную кристаллическую структуру, хорошо проводит электрический ток и стабильна при температурах выше 13,2 °C.
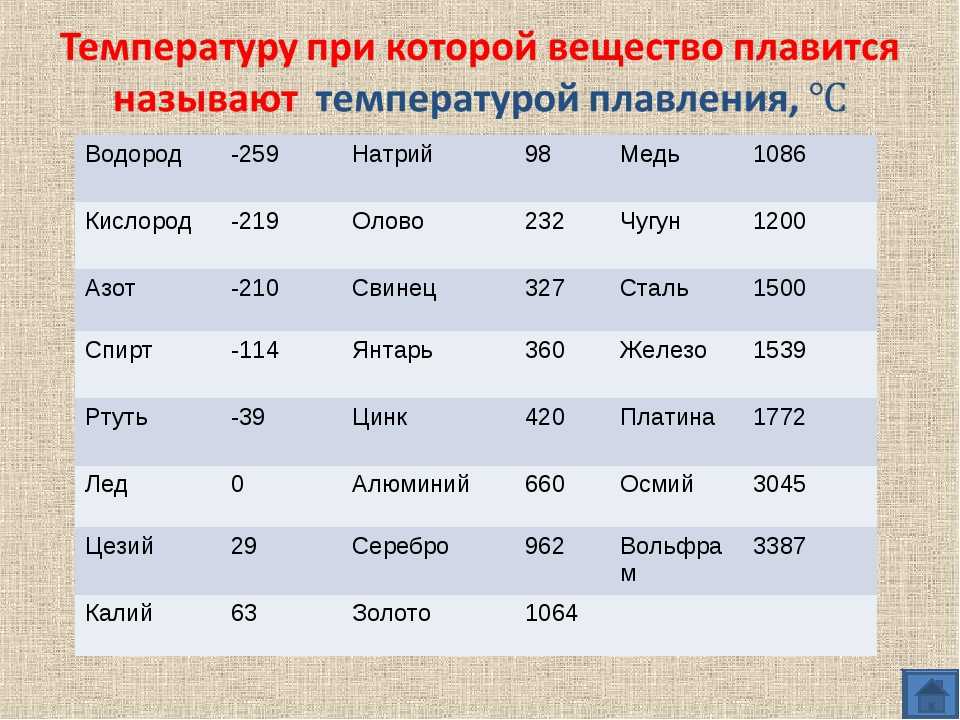
Плавится металл при относительно низкой температуре 232 °C (для сравнения: железо плавится при 1535 °C). При этом необходимо понимать, отвечая на вопрос, при какой температуре плавится олово, что плавится именно его белая аллотропная модификация. Несмотря на низкую температуру плавления, кипение металла происходит при относительно высокой температуре 2602 °C (железо кипит при 2750 °C).
Химические свойства
Наиболее важным минералом является касситерит, SnO2. Однако, в настоящее время неизвестны рудные месторождения с высоким процентным содержанием этого минерала. Большую часть касситерита в мире добывают из наносных залежей низкого качества. Именно из этого минерала получают олово в промышленных масштабах. Для этого касситерит измельчают, получая его концентрат, а затем он подвергается плавке вместе с коксом, кварцем и известью в доменной печи. После этого отливки в виде блоков проходят окончательную очистку от примесей висмута, меди и железа.
Химический элемент олово хорошо реагирует как с сильными кислотами, так и с сильными основаниями, однако относительно инертен в нейтральных растворах. Подвергается коррозии в присутствии окислительных сред, в отсутствии кислорода металл практически не подвергается коррозии. При окислении на поверхности металла образуется плотная оксидная пленка, которая защищает остальную его часть от дальнейшего окисления.
Если при растворении солей в воде образуется кислая среда, тогда в присутствии окислителей или воздуха олово вступает в реакцию. К таким солям относятся хлориды, например, алюминия и железа. Большинство неводных жидкостей, например, масла и спирты практически не вступают в реакцию с оловом. Само олово и его простые неорганические соли не являются токсичными, однако, некоторые органические композиты обладают токсичностью.
Оксид олова (II), SnO является кристаллом черно-синего цвета, который растворяется в кислотах и основаниях. Его используют для производства солей в гальванопластике и при производстве стекла. Оксид олова (IV), SnO2 представляет собой белую пыль, нерастворимую в кислотах. Его используют в качестве незаменимого компонента для окраски в розовых, желтых и коричневых керамиках, а также в диэлектриках и тугоплавких сплавов. Он является важным агентом при полировке мрамора и других декоративных камней.
Хлорид олова (II), SnCl2 является основным ингредиентом в оловянной кислоте для пайки. Хлорид олова (IV), SnCl4 используется в качестве химического ингредиента для придания веса шелковой ткани, а также для стабилизации некоторых парфюмерных продуктов и стабилизации цвета мыла, а SnF2, имеющий белый цвет и растворимый в воде, применяется в качестве добавки к зубным пастам.
Органические химические соединения на основе этого элемента — это такие соединения, в которых присутствует хотя бы одна связь олова с водородом, Sn-H, и в которых металл проявляет степень окисления +4. Органические соединения, которые нашли свое приложение в индустрии, обладают следующими химическими формулами:
- R4Sn;
- R3SnX;
- R2SnX2;
- RSnX3.
Здесь R — органическая группа, например, метил, этил, бутил и другие, а X — неорганический элемент, например, хлор, кислород, флор и другие.
Технология получения
Главный исходник для получения чистого металла – руды, содержащие галенит.

Галенит
Процесс многоступенчатый:
- На обогатительной фабрике сырье обрабатывается методом флотации. Получается 40-70% концентрат свинца.
- Чтобы получить из него черновой свинец, применяют плавку.
- Для этого оксид-концентрат обжигают, затем загружают в печь. Восстановление достигает чистоты 90%.
- Далее отделяют ценные примеси: медь, мышьяк, сурьму.
- Затем выделяются серебро, золото, цинк, висмут.
На выходе образуется свинец с содержанием примесей до 0,2%. Еще большую чистоту металла получают рафинированием.
Подготовка к плавлению свинца
Прежде чем плавить свинец нужно подготовиться к проведению технологического процесса. Подготовка представляет собой несколько этапов:
Подготовить емкость для плавки. Она должна быть изготовлена из жаростойкого материала, иметь ручки. Можно изготовить канавку, по которой будет стекать расплавленная масса.
Купить необходимое количество свинца. Для этого можно обратиться в любую компанию перерабатывающую металл
Важно выбирать металла с минимальным количеством примесей.
Большие куски свинца измельчить.
В качестве нагревательного элемента можно использовать газовую горелку, мангал, муфельную печь.
Нельзя забывать про соблюдения правил техники безопасности. К ним относятся:
- При работе использовать защитную робу, перчатки, очки, респиратор.
- Не допускать попадания влаги в расплавленный металл.
- Наладить хорошую вентиляцию в помещении.
- Убрать из рабочей зоны легковоспламеняющиеся материалы, горючие жидкости.
- Перед заливкой расплавленного металла, нужно проверить форму. Она не должна быть влажной, чтобы исключить расплескивание.
При плавке свинец выделяет ядовитые испарения, которые могут усугубить различные заболевания после попадания в организм. Если после проведения рабочего процесса появились неприятные ощущения, головокружение, слабость, необходимо обратиться к врачу.

Ручная газовая горелка
Влияние свинца на организм человека и симптомы отравления
Любые соединения свинца очень ядовиты. Металл проникает в организм вместе с едой или со вдыхаемым воздухом и разносится кровью. Причем вдыхание паров свинцовых соединений и пыли намного более опасно, чем присутствие его в пище. Свинец имеет свойство накапливаться в костях, частично замещая в этом случае кальций. При повышении концентрации свинца в организме развивается анемия, поражается головной мозг, что приводит к снижению интеллекта, а у детей может вызвать необратимые задержки в развитии. Достаточно растворить один миллиграмм свинца в литре воды и она станет не только непригодной, но и опасной для питья. Такое низкое количество свинца представляет также определенную опасность, ни цвет ни вкус воды не изменяется. Основные симптомы отравления свинцом:
- серая кайма на деснах,
- вялость,
- апатия,
- потеря памяти,
- слабоумие,
- проблемы со зрением,
- раннее старение.
Плавление в домашних условиях
Благодаря низкой температуре плавления древние люди могли расплавлять купрум на костре и использовать металл для изготовления различных изделий.
https://youtube.com/watch?v=LbSfTbupGMU
Для расплавки меди в домашних условиях понадобится:
- древесный уголь;
- тигель и специальные щипцы для него;
- муфельная печь;
- бытовой пылесос;
- горн;
- стальной крюк;
- форма для плавления.
Процесс течет поэтапно, металл помещается в тигель, а затем размещается в муфельной печи. Выставляется нужная температура, а наблюдение за процессом осуществляется через стеклянное оконце. В процессе в емкости с Cu появится окисная пленка, которую нужно устранить — открыть окошко и отодвинуть в сторону стальным крюком.
При отсутствии муфельной печи расплавить медь можно автогеном. Плавление пойдет, если ест нормальный доступ воздуха. Паяльной лампой расплавляется латунь и легкоплавкая бронза. Пламя должно охватить весь тигель.
 Если под рукой ничего из перечисленных средств нет, можно использовать горн, установленный на слой древесного угля. Для повышения Т можно использовать пылесос, включенный в режим выдувания, но шланг должен иметь металлический наконечник, хорошо, если с зауженным концом, так струя воздуха будет тоньше.
Если под рукой ничего из перечисленных средств нет, можно использовать горн, установленный на слой древесного угля. Для повышения Т можно использовать пылесос, включенный в режим выдувания, но шланг должен иметь металлический наконечник, хорошо, если с зауженным концом, так струя воздуха будет тоньше.
Температура плавления бронзы и латуни, как температура плавления меди и алюминия — невысоки.
Сегодня в промышленных условиях в чистом виде Cu не используется. В ее составе содержится много примесей: никель, железо, мышьяк, сурьма, другие элементы. Качество продукта определяется наличием содержания в процентах примесей в сплаве (не более 1%). Важные показатели — тепло- и электропроводность. Благодаря пластичности, малой Т плавления и гибкости медь широко используется во многих отраслях промышленности.