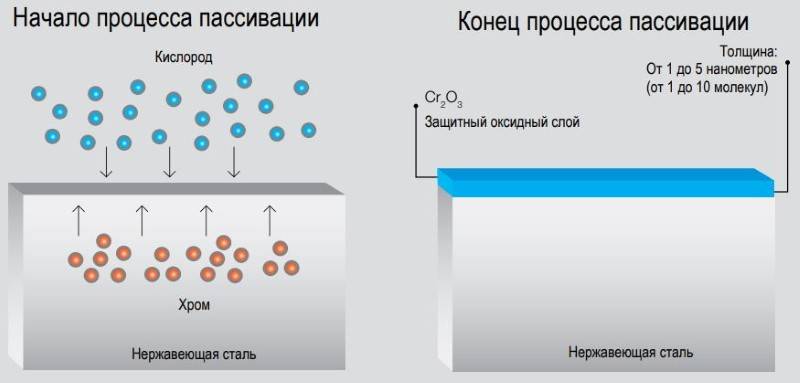
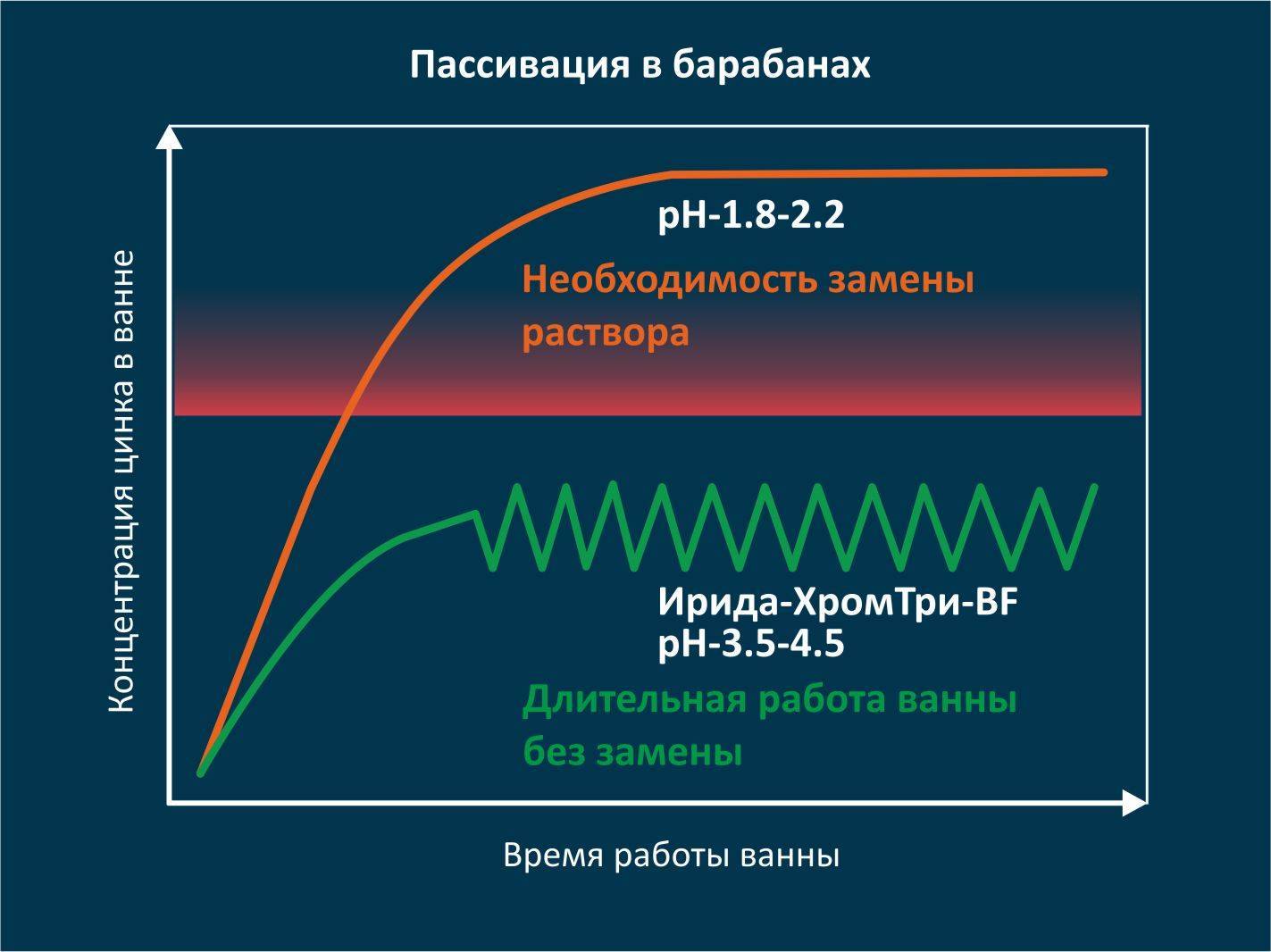
Что такое пассивация?
Процесс пассивации позволяет вернуть нержавеющей стали свои первоначальные свойства, дополнительно защищая ее от воздействия многих внешних факторов. Это специальная химическая обработка металлических изделий, после проведения которой на их поверхности образуется специальное защитное покрытие. При взаимодействии с концентрированными кислотами на нержавеющей стали появляется малозаметная пленка. Этот процесс и называется пассивацией.
Прибегают к данному методу как для дополнительной обработки во время производства изделий, так и для восстановления основных свойств деталей из нержавейки.
https://youtube.com/watch?v=ohkACgxyUqE
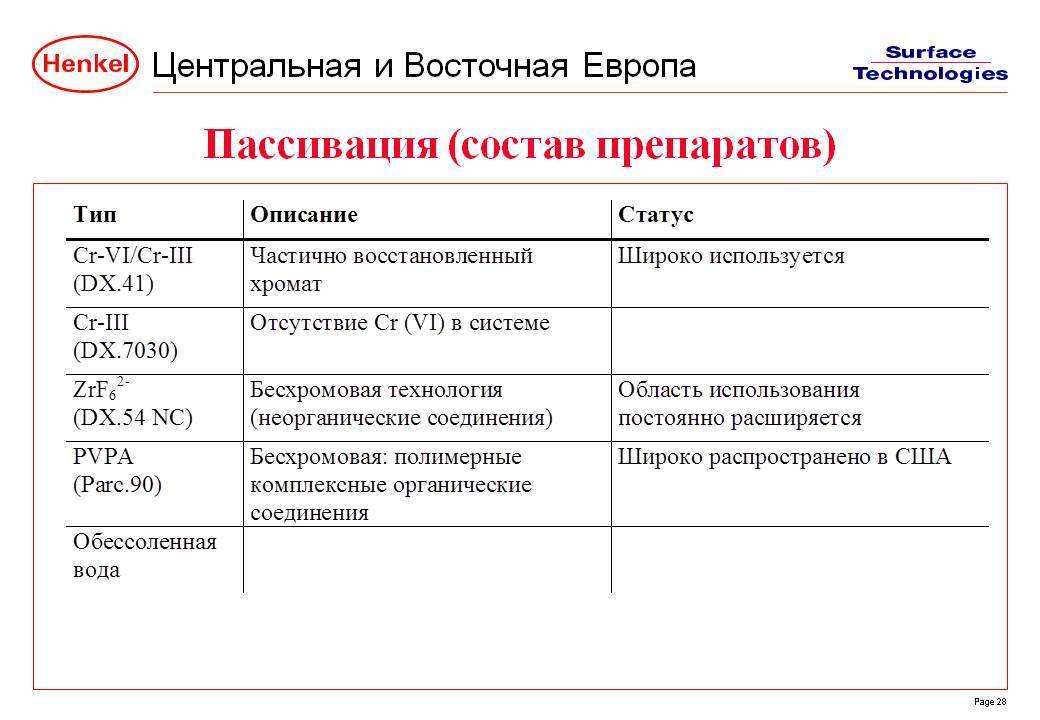
Химическое пассивирование и осветление цинковых покрытий
Слой цинка, полученный непосредственно из ванны цинкования, имеет матовый желтоватый оттенок. Блестящую поверхность он приобретает после следующих дополнительных операций:
- промывка в холодной проточной воде;
- погружение в 3%-ный раствор азотной кислоты при 1525 °С на 2-3 с;
- промывка в холодной проточной воде;
- пассивирование в 5%-ном растворе хромового ангидрида или в подкисленных растворах солей шестивалентного хрома: двухромовокислом калии, натрии или аммонии, также в течение 2-3 с (процесс часто называют хроматированием);
- промывка в холодной проточной воде и сушка сжатым воздухом. Уменьшение толщины слоя цинка при пассивировании составляет около ~1 мкм.
Пассивирование цинковых покрытий является кратковременной, но весьма эффективной операцией повышения химической стойкости цинковых покрытий и придания им декоративной внешности.
Таблица 5.9. Составы электролитов для пассивирования и режимы работы.
| Компоненты | Состав электролита (г/л) и режимы работы | |||
| I | II | III | IV | |
| Двухромовокислый натрий | 150-200 | — | 15-25 | 15-25 |
| Хромовый ангидрид | — | 100-150 | — | — |
| Серная кислота | 8-12 | 8-12 | — | — |
| Азотная кислота | — | 25-35 | 15-30 | 3-7 |
| Сернокислый натрий | — | — | 10-20 | 10-15 |
| Температура, °С | 15-35 | 15-30 | 15-30 | 15-30 |
| Продолжительность, мин | 0,1-0,3 | До 0,2 | 0,1-0,5 | 0,5-1,0 |
Операции осветления в азотной кислоте и пассивирования можно объединить в одном растворе. Наиболее применяющиеся растворы для пассивирования цинка и режим работы приведены в табл. 5.9.
Раствор I пригоден для цианистых электролитов, в растворах II—IV происходит одновременное осветление и хроматирование. Раствор II пригоден для аммиакатных и кислых электролитов. Раствор III наиболее пригоден для крепежных деталей, подвергающихся после цинкования термообработке при 180-200 °С в течение 2 ч для удаления водородной хрупкости. При этом радужная светлая пленка приобретает синий цвет. Раствор IV применяется для деталей, покрываемых цинком в автоматических линиях.
Пассивированные детали промывают в воде, подогретой не выше 40-45 °С, и сушат сжатым воздухом; промывка в горячей воде ухудшает качество пассивной пленки.Возможно Вас так же заинтересуют следующие статьи:
- Серная кислота — физические свойства
- Комбинированный метод защиты металла
- Адгезия при горячем цинковании
- Экология гальванического производства
- Контроль качества оцинкованных изделий по ГОСТ 9.307-89
comments powered by HyperComments
Пассивация – сталь – Большая Энциклопедия Нефти и Газа, статья, страница 1
Пассивация – сталь
Пассивация стали происходила кольцеобразно вокруг никелевого катода. Защитное действие никелевого катода возрастает с увеличением радиуса катода и уменьшается с увеличением скорости движения раствора и концентрации щелочи.
Пассивацию фосфатированной стали производят раствором хромового ангидрида с концентрацией до 0 2 г / л, рН раствора увеличивают с 2 5 – 2 8 до 4 – 4 5 введением гидроокиси натрия. Для приготовления пассивирующего раствора используют обессоленную воду; пассивирующий раствор меняют в среднем один раз в неделю. В ванне пассивирования каждые 3 ч определяют свободную кислотность в точках ( 0 45 – 0 55), а также температуру и давление.
Потенциалы пассивации сталей Х17, ОХ17Т и 1Х17Н2 составляют примерно – 250 мв, стали Х17Н – 300 мв и стали Х17Д – 200 мв.
Так как пассивация стали происходит в интервале значений показателя рН раствора от 11 3 до 13, арматурная сталь может считаться защищенной от коррозии, если со всех сторон покрыта бетонным слоем достаточной толщины, а бетон изготовлен с соблюдением соответствующих требований. Минимальная толщина защитного слоя бетона при контакте с водой и грунтом ( BGII – ГУ) по TGL 33408 / 02 в общем случае принимается равной 30 мм, при концентрации хлоридов в воде более 1000 мг / л – 50 мм.
Для обеспечения надежной пассивации стали конденсатного и питательного трактов общую концентрацию кислорода в воде необходимо поддерживать на уровне выше 100 мкг / кг. Верхний предел концентрации кислорода для предотвращения интенсивного вымывания отложений меди, накопившихся в тракте блока, должен быть около 300 мкг / кг.
В растворах роданидов пассивация сталей достигается увеличением рН раствора, легированием стали молибденом, а также анодной поляризацией.
Для облегчения процесса пассивации стали желательно обеспечить предварительное контактирование стали с протектором и только после этого постепенно погружать систему в раствор или медленно наполнять коррозионным раствором предварительно замкнутую на протектор емкость.
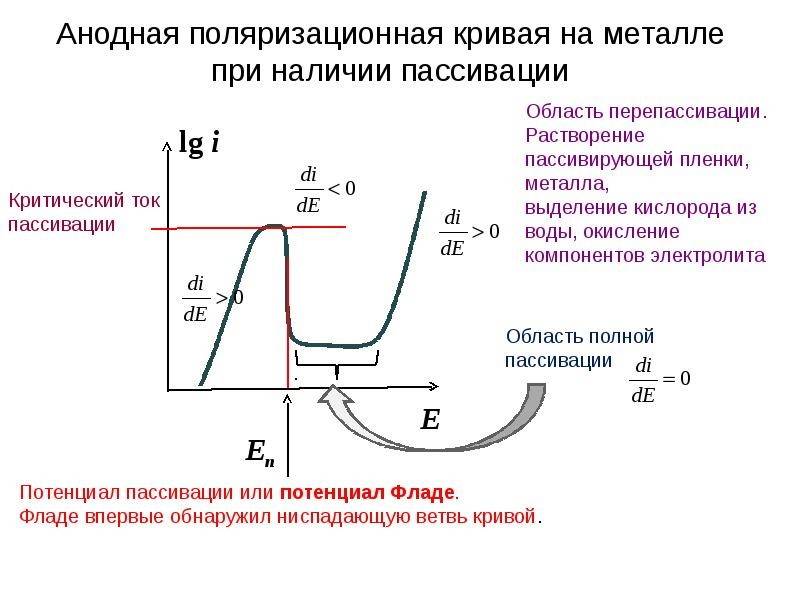
Повышение температуры вызывает затруднение пассивации сталей, что выражается в увеличении тока пассивации ( рис. 54), смещении потенциала пассивации ( см. рис. 50) и потенциала полной пассивации ( рис. 55) в положительную сторону.
Как видно, в первой серии опытов пассивация стали достигается легче, при значительно меньшей относительной площади протектора. В этих условиях для пассивации стали требуются меньшие токи вследствие того, что образцы нержавеющей стали в исходном состоянии в какой-то степени запассивированы кислородом воздуха, и, кроме того, постепенное погружение стали в раствор приводит к значительному увеличению отношения площади катода к аноду в первоначальный момент.
Проведенными – исследованиями показано, что склонность к пассивации сталей в горячих концентрированных хлоратсодер-жащих растворах щелочи усиливается по мере понижения содержания в сплаве никеля. Легче всего в этих условиях пассивируется безникелевая сталь 15Х25Т, труднее – сталь 12Х18Н10Т; эко-номнолегированные стали занимают промежуточное положение.
С увеличением содержания никеля снижается критическая плотность тока пассивации стали и расширяется область устойчивой пассивности. KCNS зависимость потенциала питтингообразования стали 12Х18Н10Т от температуры, как и для никеля, имеет минимум при 50 С, что согласуется с данными, полученными в работе для той же стали при близких значениях рН и концентрации раствора. Поверхность хромоникелевых сталей, как и чистого никеля, покрывается слоем нерастворимых сульфидов, которые удаляются с поверхности механическим способом. Увеличение содержания частиц 35S на стали 12Х18Н10Т с ростом температуры, вероятно, связано с более интенсивным образованием NiS на поверхности хромоникелевой стали.
Молибден, который является стабилизатором ферритной фазы, способствует пассивации стали ( повышает нижнюю границу потенциала питтингообразования) и тем самым повышает коррозионную стойкость. Добавка Мо способствует также повышению анодной поляризуемости, возможно, вследствие адсорбции на поверхности стали образующихся продуктов коррозии, но механизм действия Мо, очевидно, иной, чем у Ni, так как молибден не только уменьшает питтингообразование, но и снижает вероятность подповерхностной коррозии.
Страницы: 1 2 3 4
Пассивация металла — принцип, назначение, виды
Нержавеющая сталь – это особый металл, длительное время не поддающийся коррозии. Из нее изготавливаются различные детали и декоративные предметы. Но если изделие будет использоваться в сложных условиях, в которых коррозия грозит даже ему, то обязательно проводится пассивирование металла.
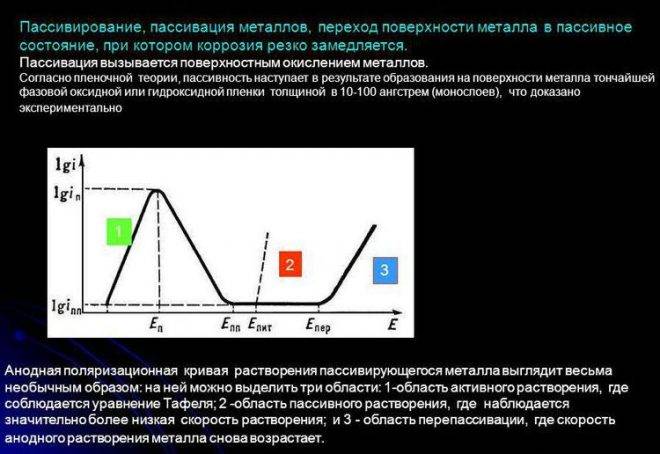
Механизм пассивации
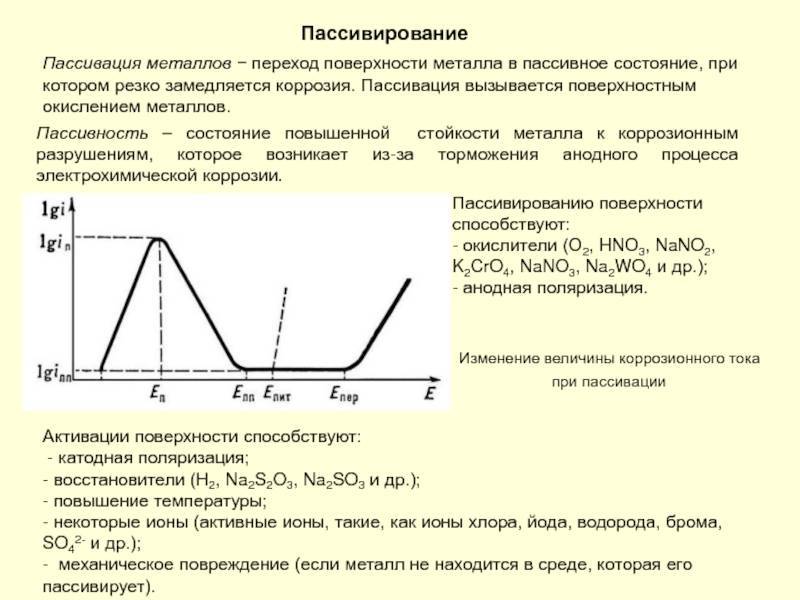
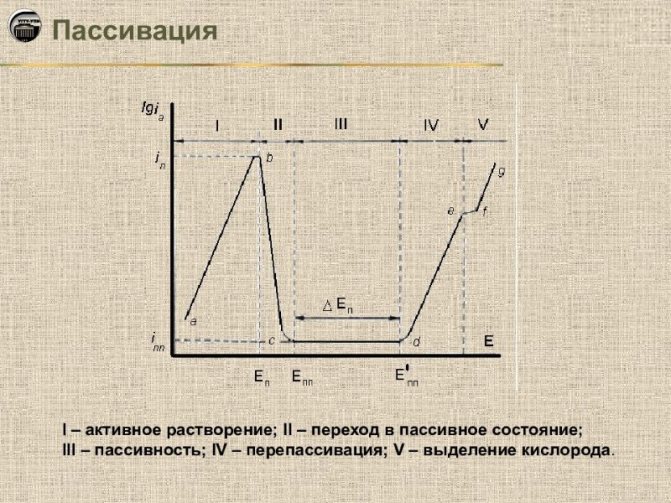
При взаимодействии металлов с теми или иными компонентами растворов (расплавов) в определённом диапазоне потенциалов на поверхности металла образуются адсорбционные или фазовые слои (плёнки). Эти слои образуют плотный, почти непроницаемый барьер, благодаря чему коррозия сильно замедляется или полностью прекращается.
Пассивация проводится химически или электрохимически. В последнем случае создаются условия, когда ионы защищаемого металла под действием тока переходят в раствор, содержащий ионы, способные к образованию очень малорастворимых соединений.
: Отжиг стали — температура, режимы, виды
Химическое пассивирование
Химическое пассивирование проводят окунанием либо непосредственным нанесением реагентов на саму поверхность без применения электрического тока. В зависимости от используемых веществ, химическое пассивирование может проводиться при комнатной температуре или с подогревом электролита.
Причины устойчивости металла
Процесс коррозии характеризуется тем, что постепенно окисляясь под воздействием негативных факторов, поверхность нержавеющей стали разрушается. Если не предпринимать никакие меры, то деструкция будет поражать более глубокие его слои.
Таблица устойчивости металлов в разных средах
Пассивирование металла позволяет избежать представленной проблемы. Поверхность изделия покрывается защитной оксидной пленкой, а специальные добавки, входящие в раствор для обработки, улучшают свойства нержавейки. Новый материал не имеет повреждений.
В промышленных условиях есть возможность получить идеальный по толщине и однородности слой защиты от коррозии. Если условия, в которых будет использоваться изделие, не слишком агрессивные, то дополнительная обработка ему не нужна
Важно помнить, что механическое повреждение стали дает толчок коррозионным процессам
Электрохимическое пассивирование
Проводят в растворах окислителей при воздействии электрического тока. Под воздействием тока частицы оседают на поверхности защищаемого изделия, создавая защитный слой. Этот слой, состоящий из малорастворимых соединений, получается более равномерный, чем при использовании метода химического пассивирования.
Пассивация меди проводится чаще всего с применением хроматных растворов, т.к. после обработки наблюдается хорошая коррозионная стойкость металла в растворах нейтральных солей и средах, содержащих SO2.
Пассивирование оцинкованных изделий проводят в растворах, содержащих 200 г/л Na2Cr2O7•2H2O и 8 – 10 мл/л H2SO4. Обработку производится чаще всего методом окунания в раствор на 5 – 30 секунд. При выдержке 5 секунд пленка получается радужная с зеленоватым оттенком. При длительности 30 секунд – коричневая.
Виды пассивации
В настоящее время по способу проведения пассивации выделяются следующие виды пассивации:
Данный вид пассивации заключается в том, чтобы нанести на поверхность металла солей и кислых растворов наряду с электролитом. В итоге проведения данной процедуры на поверхности металла оседают заряженные частицы, которые образую тонкую пленку, обеспечивающую надежную защиту от коррозии.
Данная процедура подразумевает обработку металлов химическими реагентами, которые образуют на их поверхности защитную пленку. Для этого применяются растворы, которые состоят из никеля, хрома и других элементов. Они делают структуру металла более плотной и твердой.
: Пермаллой — магнитная проницаемость, свойства, применение
Суть и описание процесса пассивации металла
При пассивировании поверхности металлических изделий обрабатывают растворами химических соединений, обладающих окислительными свойствами. В этой роли чаще всего выступают кислоты, нитриты и растворы солей хрома (реже — молибдена). Нанесение раствора на поверхность металлических заготовок производится методом погружения или вручную, с помощью специального оборудования. Применяемые при пассивировании растворы обычно состоят из основного реагента и нескольких добавок, ускоряющих и стабилизирующих процесс пассивации.
Пассивация – сталь – Большая Энциклопедия Нефти и Газа, статья, страница 3
Пассивация – сталь
Хромоникельмолибденовые стали применяются для изготовления аппаратуры, работающей в сильно агрессивных средах: в серной кислоте при концентрации 10 – 12 % и температуре 40 – 50 С, в горячих растворах h3SO3, в горячей фосфорной кислоте, в кипящих растворах уксусной, щавелевой и муравьиной кислот и др. На рис. 163 приведены кривые пассивации хромо-никельмолибденовых сталей с содержанием молибдена 2 5 и 3 5 % в растворах h3SO4 при разных температурах.
Пассивация стали в 67 % – ной h3S04 возможна при содержании фтористоводородной кислоты до 2 моль / л, причем скорость коррозии в пассивном состоянии при этом еще очень мала.
Пассивация является завершающей операцией химической очистки. Проведение операций по пассивации стали для котла, подлежащего консервации, уменьшает стояночную коррозию. Периодическое проведение пассивации котла, совмещаемое с его растопкой, уменьшает образование продуктов коррозии в эксплуатации.
Мощность выпрямителя в зависимости от защищаемой системы должна быть 0 05 – 1 а на 1 м2 защищаемой поверхности. Эта величина необходима для пассивации стали, когда расход тока более высокий. При дальнейшей работе расход тока снижается более чем в 10 раз.
Как видно, в первой серии опытов пассивация стали достигается легче, при значительно меньшей относительной площади протектора. В этих условиях для пассивации стали требуются меньшие токи вследствие того, что образцы нержавеющей стали в исходном состоянии в какой-то степени запассивированы кислородом воздуха, и, кроме того, постепенное погружение стали в раствор приводит к значительному увеличению отношения площади катода к аноду в первоначальный момент.
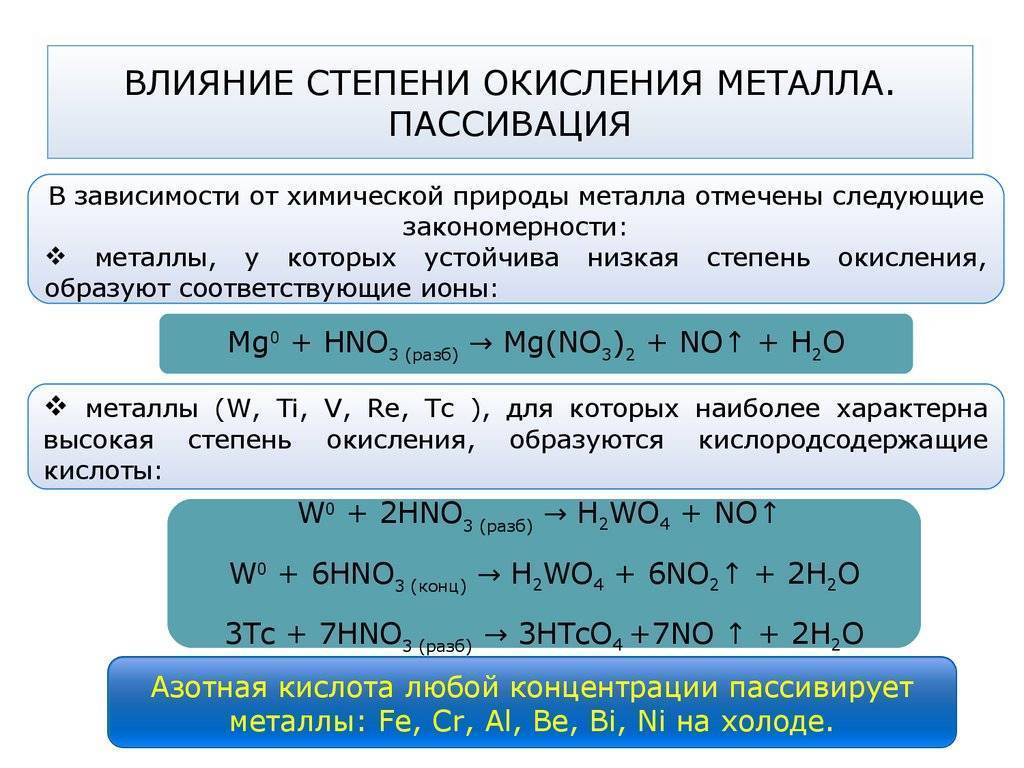
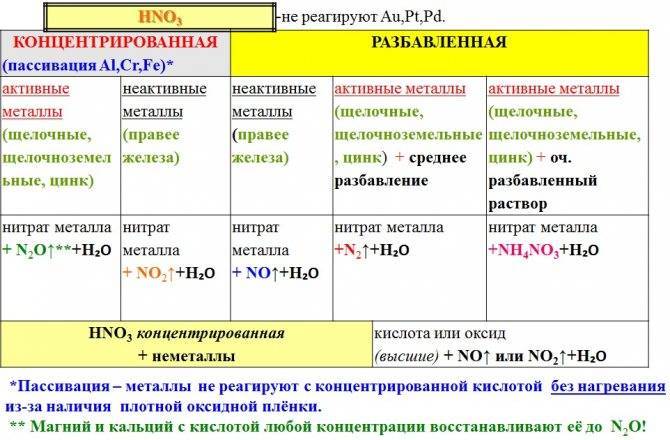
Углеродистые стали интенсивно разрушаются в водных растворах азотной кислоты. Азотная кислота с концентрацией выше 80 % вызывает пассивацию улеродистой стали. Однако все же скорость ее коррозии даже в концентрированной кислоте настолько высока, что ее нельзя применять для изготовления оборудования, работающего под воздействием азотной кислоты.
Чтобы пассивирование поверхности металла было эффективным, примеси сульфатов и хлоридов в пигментах на основе 2пСгО4 ( или ZnMoO4) должны быть малы. Представляется очевидным, насколько нецелесообразно применять ингибирующие пигменты для пассивации сталей в присутствии большого количества хлоридов, например в морской воде.
Известно, что бетоны на жидком стекле характеризуются повышенной проницаемостью, которая способствует понижению щелочности находящейся в них влаги под действием углекислоты воздуха или вымывания водой. Но и первоначальный уровень щелочности не может быть признан достаточным для надежной пассивации стали. В кислотоупорных бетонах образовавшийся силикатный камень состоит в основном из геля кремнекисло-ты и остатков щелочных окислов, содержание которых все время закономерно – уменьшается, не обеспечивая пассивности стали. Кроме того, способствует депассива-ции стали образующийся в результате реакции твердения фтористый натрий. Таким образом, состояние стальной арматуры в бетоне на жидком стекле с кремнефто-ристым натрием не может быть пассивным, и скорость коррозии ее будет зависеть от условий эксплуатации конструкции.
На рисунке 4 приведен сводный график скорости коррозии стали с комбинированным покрытием в вышеуказанных электролитах. Как видно, наименьшая скорость коррозии наблюдается а среде h3SO4, так как серная кислота способствует пассивации стали и плазменного покрытия. Коррозия протекает в значительно меныией степени, чем в солевом растворе и концентрированной азотной кислоте. Так на 75 минуте выдержки в серной кислоте было отмечено появление запаха сероводорода и раствор приобрел желтую окраску.
Для решения проблемы материального оформления этого процесса было исследовано влияние азотной кислоты на коррозионно-электрохимическое поведение сталей в серноазотных кислых смесях, содержащих 10 – 50 % h3SC4 и до 10 % НМОз. Показано, что при достижении определенной концентрации азотной кислоты потенциал сталей смещается в положительную сторону, происходит пассивация сталей, и скорость коррозии их резко уменьшается.
В том случае, когда вода движется по стальным трубам, скорость коррозии постепенно снижается из-за снижения концентрации кислорода. В турбулентном потоке речной воды к поверхности стали подводится количество кислорода, достаточное для того, чтобы обеспечить пассивацию стали и уменьшить скорость коррозии.
Страницы: 1 2 3 4
Зачем это необходимо?
Лист нержавеющей стали имеет на своей поверхности очень тонкую оксидную пленку. Именно она и препятствует образованию ржавчины на деталях, крепежах, метизах, изготовленных из этого материала. Но малейшее нарушение целостности этого покрытия приводит к тому, что основные антикоррозийные свойства нержавейки утрачиваются. Причины повреждения оксидной пленки могут быть самыми разными:
при контакте материала с хлором; при взаимодействии стали с морской водой; в случае повреждений механическим или физическим путем, в том числе при царапинах и незначительных вмятинах.
Поэтому важно соблюдать условия эксплуатации, которые регламентированы заводами-производителями тех или иных изделий (столовых приборов, крепежей, метизов, рабочих инструментов, цельных листов и проч.). Запрещается использовать моющие средства, имеющие в своем содержании хлор и иные агрессивные химические вещества. Но самый большой ущерб оксидной пленке наносит сварка
Но самый большой ущерб оксидной пленке наносит сварка
Особенно это губительно в случае сварки труб. В такой ситуации защитная поверхность разрушается вдоль всего шва. Для восстановления поверхностей и защиты изделий от образования ржавчины применяется пассивация стали. Но здесь еще не менее важную роль играет и состав нержавейки
Но самый большой ущерб оксидной пленке наносит сварка. Особенно это губительно в случае сварки труб. В такой ситуации защитная поверхность разрушается вдоль всего шва. Для восстановления поверхностей и защиты изделий от образования ржавчины применяется пассивация стали. Но здесь еще не менее важную роль играет и состав нержавейки.
Причины появления коррозии на металле
Коррозия – разрушение поверхности стали под воздействием внешних негативных факторов. Даже химическая обработка поверхности не всегда способна защитить материал от развития деструктивных процессов во внутренних слоях. Существуют такие причины развития коррозии нержавеющего металла:
 Ржавление и коррозия
Ржавление и коррозия
- низкое содержание хрома в составе стали;
- прямой контакт с материалом, не обладающим таким же уровнем устойчивости к окислению и коррозии;
- очищение посуды или деталей при помощи хлорсодержащих средств тоже повреждает оксидную пленку;
- соединение частей нержавейки при помощи сварки (защитный слой в этом месте разрушается во время обработки).
Чтобы ржавчина не появилась на нержавеющей стали после процедуры, то шов должен быть тщательно очищен, отшлифован и отполирован. Только в этом случае можно устранить остатки тех материалов, которые разрушаются быстрее.
Частички неустойчивых к коррозии металлов часто попадают на нержавеющую поверхность, если рядом производилась их резка или шлифовка. Лучше не использовать для обработки пассивированного металла инструменты, которые контактировали с обычными материалами. Тут уже лучше использоваться однотипными изделиями.
Виды коррозии
Пассивирование нержавейки поможет защитить ее от таких видов коррозии:
- Щелевой. Она чаще проявляется в местах соприкосновения материалов, например: в области крепежа. Развивается такой деструктивный процесс вследствие механического повреждения защитной пленки.
- Гальванической. Коррозионная устойчивость нержавеющего металла снижается при соприкосновении с другим материалом в условиях токопроводящей среды. Ситуация ухудшается, если деталь постоянно находится в морской воде.
- Межкристаллитной. Такое разрушение металла появляется в том случае, если изделие несколько раз сильно перегревалось. Этот процесс способствует формированию карбидов железа и хрома на кристаллической решетке нержавейки.
- Эрозивной. Она может развиваться в том случае, если на металл периодически воздействует абразивный материал. Оксидная пленка просто не успевает быстро восстановиться, появляется ржавчина.
Чтобы такие проблемы не возникали, нужно обязательно пройти пассивирование материала.
Виды пассивации
Основными и наиболее хорошо отработанными видами пассивации являются:
- химическая;
- электрохимическая.
Химическая
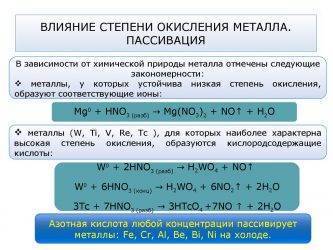
Химическая пассивацияпредполагает применение растворов солей различных металлов.Наиболее эффективно пассивация производится азотной кислотой. Кроме неё для формирования раствора пользуются серной кислотой или лимонной. Для повышения качества процесса в раствор добавляют небольшое количество бихромата натрия. Его количество не превышает 6% от общей массы. Состав раствора подбирается индивидуально и во многом зависит от марки обрабатываемого металла. Например, для пассивации железа применяют соли металлов, растворённые в серной кислоте высокой концентрации.
Сущность химической пассивации заключается в активном притяжении отрицательных ионов, которые присутствуют в растворе, к атомам металла.Это происходит благодаря наличию у них положительного заряда. В результате такой диффузии образуется поверхностный слой.
Для пассивации обязательно проводят предварительную подготовку поверхности изделия. Её тщательно зачищают механическими и химическими методами.От качества этой процедуры зависит конечный результат и надёжность образованной плёнки.Большое значение это имеет при пассивации цветных металлов: латуни, меди, бронзы.
Электрохимическая
Этот вид пассивации основан на принципах, заложенных в технике гальванической обработки изделий. Ускорение обработки осуществляется благодаря воздействию постоянного тока, который протекает через раствор, ускоряя химическую реакцию. Такая пассивация называется электрохимическая.
В состав такой установки кроме ванны, в котором размещают электролит, используется источник постоянного тока, соединительные провода и один электрод. Вторым электродом является сама деталь.Другим вариантом контактов являются один электрод и корпус ванной (она должна быть изготовлена из металла, стойкого к воздействию электролита и электрического тока). На практике применяют электрические установки с относительно невысоким уровнем напряжения. Его величина не превышает 12В.
В обоих случаях при включении установки через раствор пропускают электрический ток. Он является стимулятором протекания процесса пассивации на поверхности заготовки. На практике различаю анодную и катодную пассивацию.
При такой пассивации положительный потенциал подается на заготовку, а отрицательный — на корпус ванны. При использовании электрохимического способа защитная пленка образуется быстрее и получается более ровной. Но такая технология дороже химической пассивации, т. к. в ней применяется более сложное оборудование и происходит расход электроэнергии.Под его действием защитная пленка получается равномерной. Именно так формируется плёнка на поверхности медных заготовок. Ток пропускают через растворы с растворёнными в них солями хрома. Именно в них медь приобретает наибольшую стойкость к коррозии.
Важными параметрами в этом процессе является время протекания пассивации, плотность и состав электролита, критическая величина тока пассивации. Эти параметры рассчитаны для различных металлов и приведены в специальных таблицах. На основании этих данных рассчитывают допустимое время обработки.
Свойства металла после обработки
Основной задачей пассивации является улучшение физико-химических и механических характеристик поверхностного слоя материала, из которого изготовлена деталь. Остальные характеристики более глубоких слоёв сохраняются неизменными. Поэтому после завершения пассивации в поверхностном слое изменяются следующие свойства и характеристики:
- возникает слой с новым химическим составом;
- изменяется антикоррозийная активность (она значительно замедляется);
- улучшаются физические характеристики материала (только поверхностного слоя);
- в отдельных случаях повышается механическая прочность изделия;
- изменяется цвет детали (она приобретает более эстетичную форму);
- повышаются потребительские свойства, и улучшается товарный вид.
Пассивация нержавеющей стали позволяет значительно повысить антикоррозийные свойства и придать готовой детали совершенно другой цвет. Применение хрома или никеля в составе пассивирующего раствора позволяет получить блестящий металлический цвет.
Аналогичным образом изменяются свойства поверхностного слоя цветных металлов. В результате пассивации образуются определённой толщины адсорбционные или фазовые слои. Помещение заготовки из алюминия стимулирует процесс естественной пассивации поверхностного слоя этого металла. При воздействии кислотных растворов защитные свойства поверхностного слоя алюминия увеличиваются.
Взаимодействие алюминия с простыми веществами
с кислородом
При контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава Al2O3, которая защищает алюминий от дальнейшего окисления. Невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. Тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
с галогенами
Алюминий очень энергично реагирует со всеми галогенами. Так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:
С бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
Реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. Алюминий эффектно сгорает в хлоре в соответствии с уравнением:
с серой
При нагревании до 150-200 о С или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
— сульфид алюминия
с углеродом
При температуре около 2000 o C алюминий взаимодействует с углеродом и образует карбид (метанид) алюминия, содержащий углерод в степени окисления -4, как в метане.