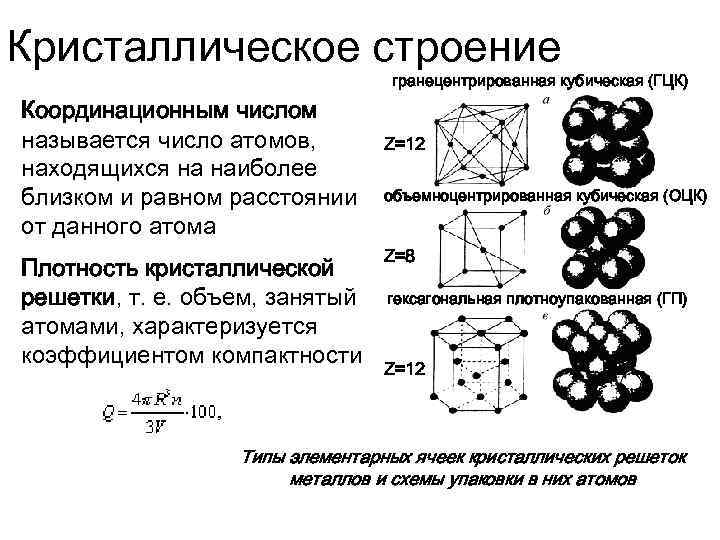
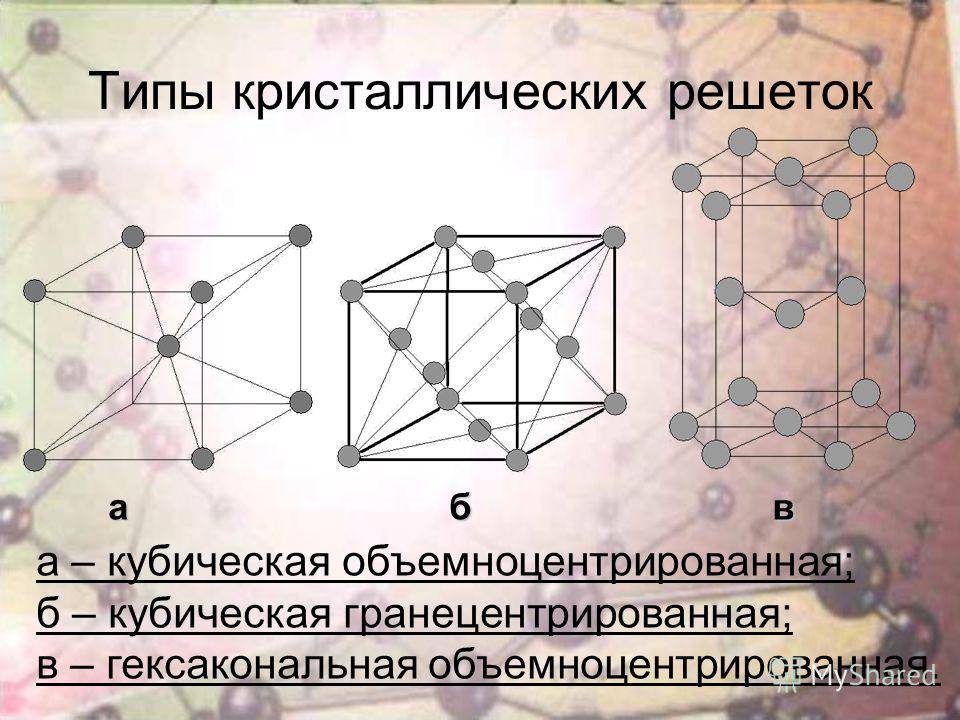
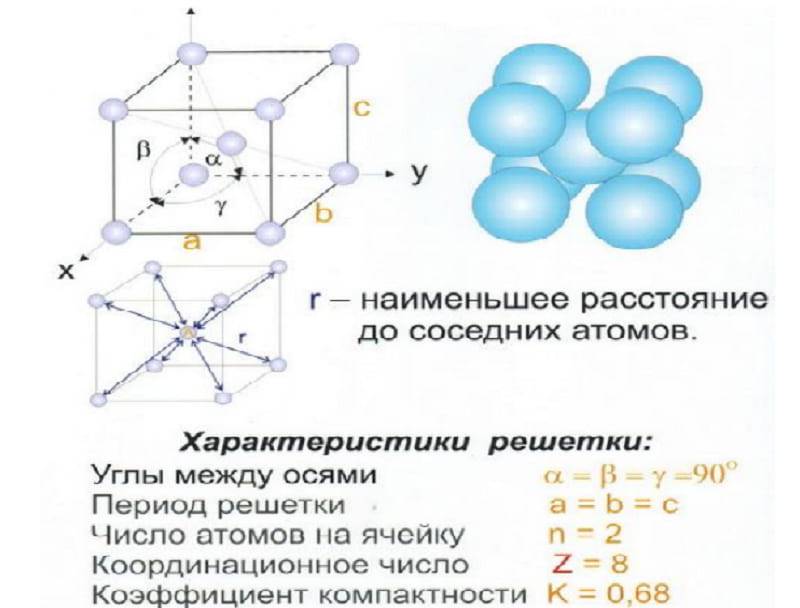
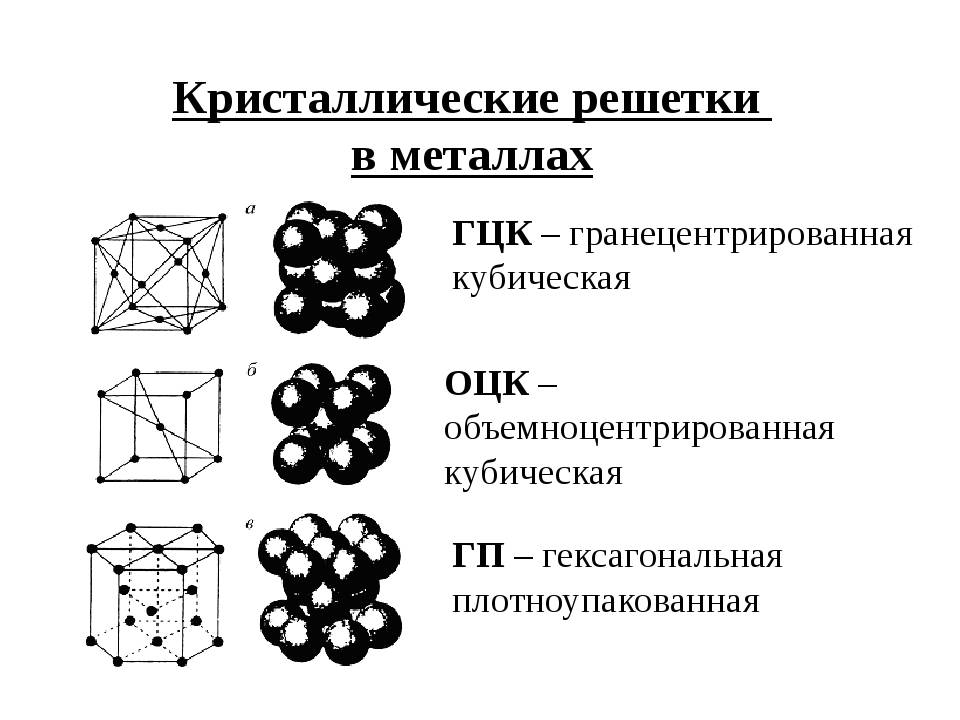
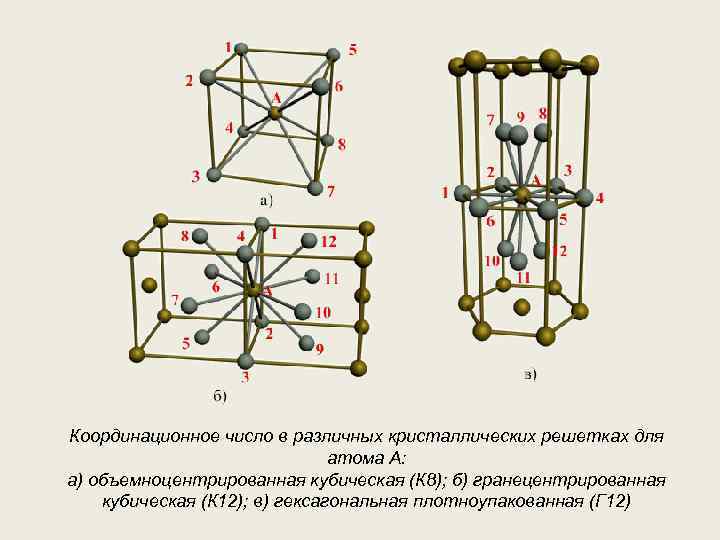
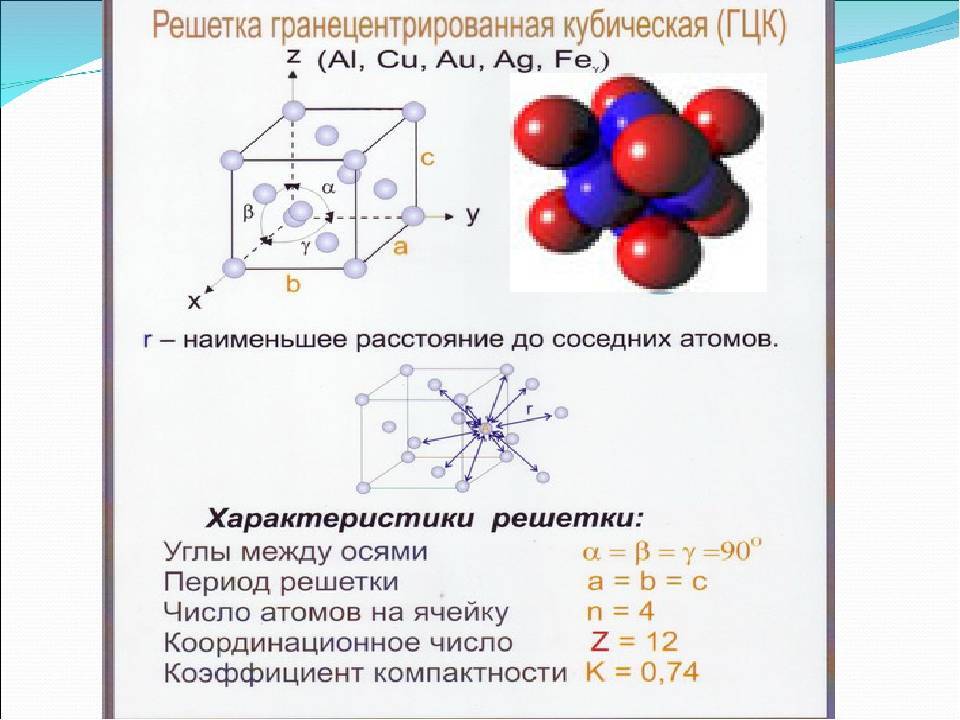
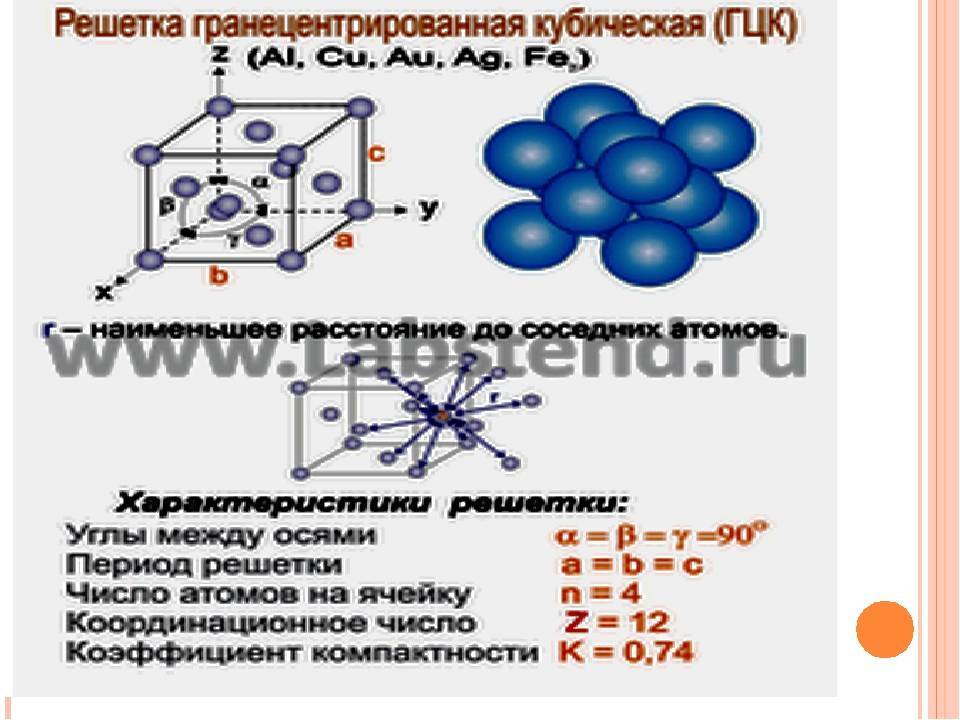
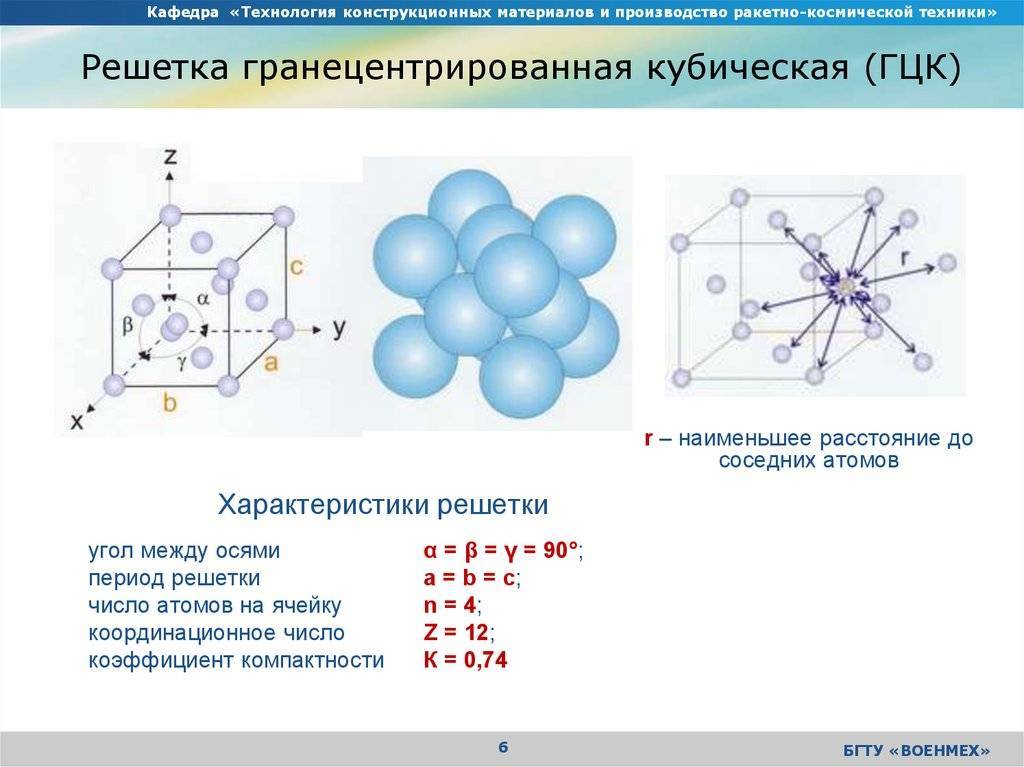
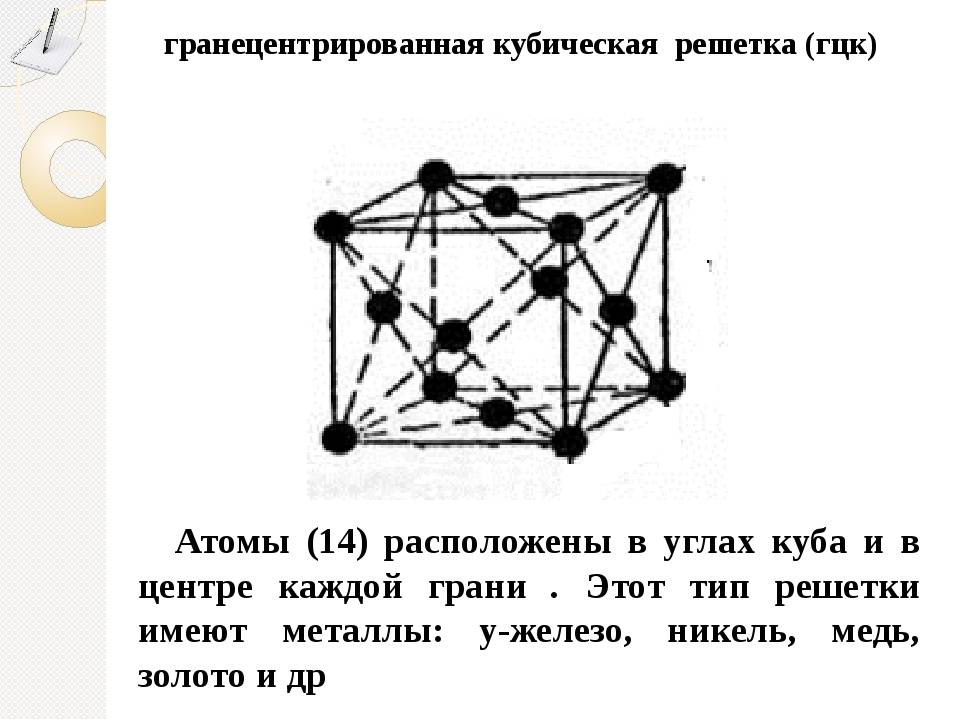
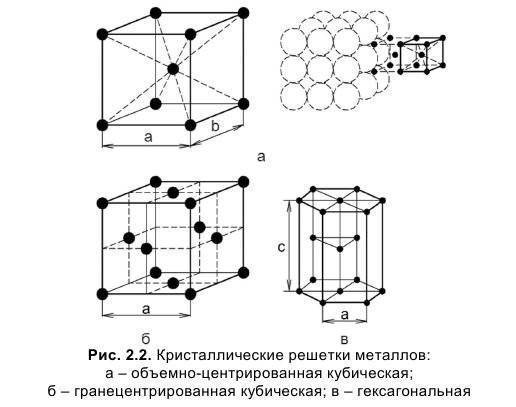
Элементарная ячейка, параметры решетки, виды элементарных ячеек, структурные типы.
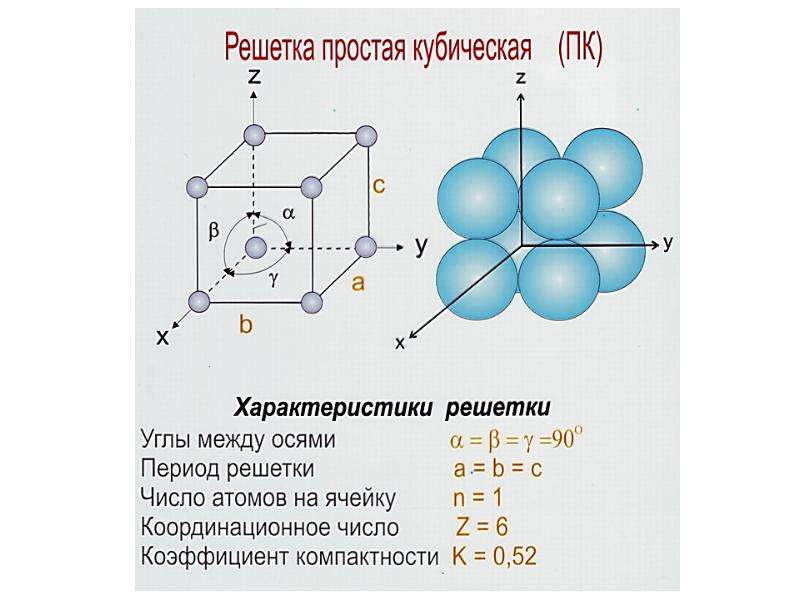
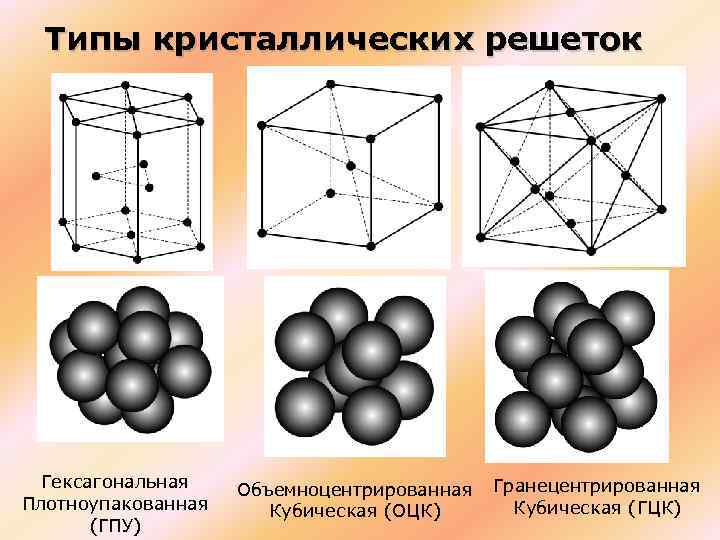
Элементарные ячейки являются кирпичиками кристалла. Существует всего семь типов элементарных ячеек: кубическая, тетрагональная, гексагональная, тригональная, ромбическая, моноклинная и триклинная. Эти элементарные ячейки иногда называют примитивными, или сингониями. Каждая из сингоний представлена примитивной кристаллической ячейкой. Кроме того, существуют еще семь типов центрированных ячеек, которые содержат частицы на гранях и внутри ячейки. Всего существует 14 типов элементарных ячеек, которые называются решетками Браве, по имени французского ученого, который показал, что любую ячейку можно преобразовать в одну из 14. Чтобы выбрать ячейку, наиболее полно отражающую все особенности данной решетки, нужно придерживаться следующих правил:
симметрия ячейки должна соответствовать симметрии решетки в целом;
число прямых углов в ячейке должно быть максимальным;
объем ячейки должен быть минимальным.
·
Объемо Кристалли́ческая структу́ра — такая совокупность атомов, в которой с каждой точкой кристаллической решётки связана определённая группа атомов, называемая мотивной единицей, причём все такие группы одинаковые по составу, строению и ориентации относительно решётки. Можно считать, что структура возникает в результате синтеза решётки и мотивной единицы, в результате размножения мотивной единицы группой трансляции.
В простейшем случае мотивная единица состоит из одного атома, например в кристаллах меди или железа. Возникающая на основе такой мотивной единицы структура геометрически весьма сходна с решёткой, но все же отличается тем, что составлена атомами, а не точками. Часто это обстоятельство не учитывают, и термины «кристаллическая решётка» и «кристаллическая структура» для таких кристаллов употребляются как синонимы, что нестрого. В тех случаях, когда мотивная единица более сложна по составу — состоит из двух или большего числа атомов, геометрического сходства решётки и структуры нет, и смешение этих понятий приводит к ошибкам. Так, например, структура магния или алмаза не совпадает геометрически с решёткой: в этих структурах мотивные единицы состоят из двух атомов.
Основными параметрами, характеризующими кристаллическую структуру, некоторые из которых взаимосвязаны, являются следующие:
• тип кристаллической решётки (сингония, решётка Браве);
• число формульных единиц, приходящихся на элементарную ячейку;
• пространственная группа;
• параметры элементарной ячейки (линейные размеры и углы);
координаты атомов в ячейке;
Понятие структурный тип — один из критериев сходства или различия строения кристаллов. Обычно структурный тип относят к названию одного из веществ, кристаллизующихся в нём. Структуры кристаллов, принадлежащих к одному структурному типу, одинаковы до подобия. Структурный тип в кристаллографии определяет относительное расположение частиц (атомов или атомных групп) в кристалле, без указаний абсолютных расстояний между ними. Чтобы описать конкретную структуру, надо указать структурный тип и параметры структуры.
Структура кристалла − это конкретное расположение частиц в пространстве. Описывая структуру, необходимо указать вид и размер частиц, а также расстояния между ними. Если вещества кристаллизуются в сходных друг с другом решетках, то говорят, что они относятся к одному структурному типу
. У кристаллов, принадлежащих к одному структурному типу, элементарные ячейки одинаковы с точностью до подобия. Опишем некоторые наиболее часто встречающиеся структурные типы .
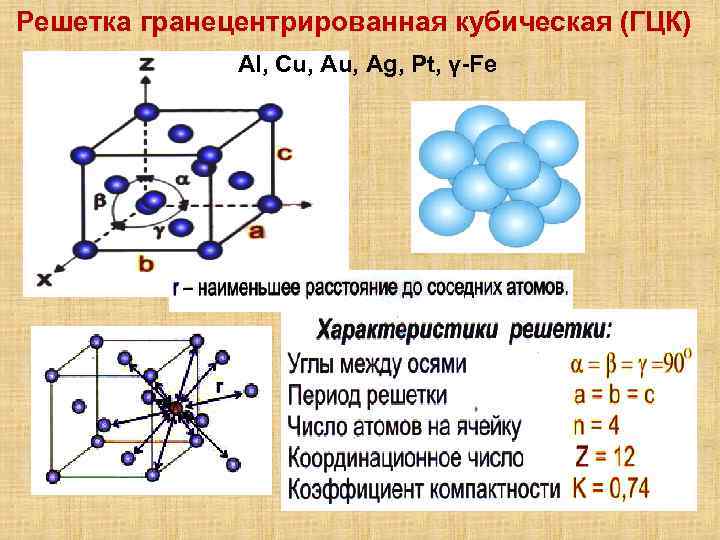
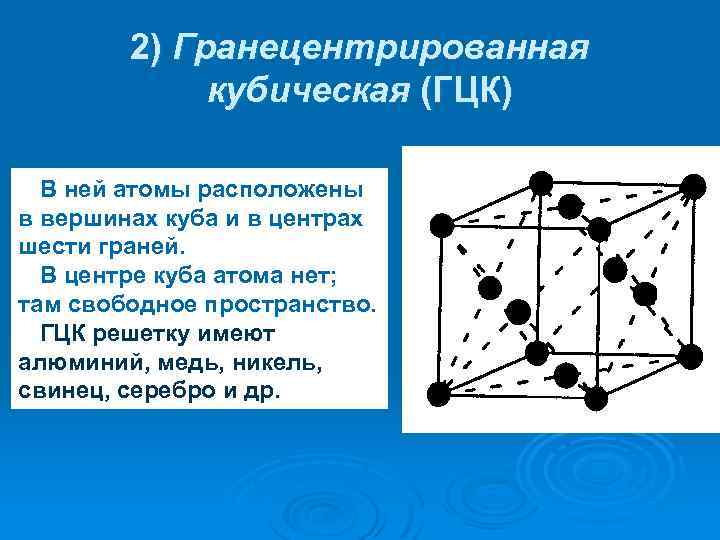
Опытные данные показывают, что почти 80 % металлов кристаллизуются в объемно- и гранецентрированных кубических, а также в гексагональных плотноупакованных решетках.
Билет 5
Многоэлементные соединения
Соединения, которые состоят из более чем один элемент (например, бинарные соединения ) часто имеет кристаллическую структуру, основанную на кубической кристаллической системе. Здесь перечислены некоторые из наиболее распространенных.
Структура хлорида цезия
элементарная ячейка хлорида цезия
Пространственная группа структуры хлорида цезия (CsCl) называется Pm3m (в нотации Германа – Могена ) или «221» (в Международных таблицах для кристаллографии). Обозначение Strukturbericht – «B2».
Помимо самого хлорида цезия, структура также проявляется в некоторых других галогенидах щелочных металлов, когда они получены при низких температурах или высоких давлениях. Как правило, эта структура с большей вероятностью будет образована из двух элементов, ионы которых имеют примерно одинаковый размер (например, ионный радиус Cs = 167 мкм, а Cl = 181 мкм).
Координационное число каждого атома в структуре равно 8: центральный катион координируется с 8 анионами в углах куба, как показано, и аналогично центральный анион координируется с 8 катионов по углам куба.
Другими соединениями, имеющими структуру, подобную хлориду цезия, являются CsBr, CsI, высокотемпературный RbCl, AlCo, AgZn, BeCu, MgCe, RuAl и SrTl.
Структура каменной соли
октаэдрической геометрией
пространственная группа структуры каменной соли (NaCl) называется Fm3m (в нотации Германа – Могена ), или «225» (в Международных таблицах для кристаллографии). Обозначение Strukturbericht соответствует “B1”.
В структуре каменной соли или хлорида натрия (галита ) каждый из двух атомов Типы образуют отдельную гранецентрированную кубическую решетку, при этом две решетки взаимопроникают, образуя трехмерный узор в виде шахматной доски. С другой стороны, можно было бы рассматривать эту структуру как гранецентрированную кубическую структуру с вторичными атомами в ее октаэдрических отверстиях.
Примеры соединений с этой структурой включают сам хлорид натрия, наряду с почти всеми другими галогенидами щелочных металлов, и «многие оксиды, сульфиды, селениды и теллуриды двухвалентных металлов». В более общем смысле, эта структура с большей вероятностью будет образована, если катион несколько меньше, чем анион (отношение радиусов катион / анион от 0,414 до 0,732).
Координационное число каждого атома в этой структуре равно 6: каждый катион координирован с 6 анионами в вершинах октаэдра, и аналогично каждый анион координирован с 6 катионами в вершины октаэдра.
Межатомное расстояние (расстояние между катионом и анионом, или половина длины элементарной ячейки a) в некоторых кристаллах со структурой каменной соли составляет: 2,3 Å (2,3 × 10 м) для NaF, 2,8 Å для NaCl, и 3,2 Å для SnTe.
Другими соединениями, имеющими структуру, подобную каменной соли, являются LiF, LiCl, LiBr, LiI, NaF, NaBr, NaI, KF, KCl, KBr, KI, RbF, RbCl, RbBr, RbI, CsF, MgO, PbS, AgF, AgCl, AgBr и ScN.
Структура флюорита и антифлюоритовые структуры (AB 2) также являются структурами Fm3m, но имеют Соотношение ионов 1: 2. Они обозначены положениями Вайкоффа 4a и 8c, тогда как положения структур каменной соли – 4a и 4b.
Структура цинковой обманки
Пространственная группа структуры цинковой обманки называется F43m (в нотации Германа – Могена ) или 216. Обозначение Strukturbericht – «B3».
Структура цинковой обманки (также обозначаемая как «цинковая обманка» “) назван в честь минеральной цинковой обманки (сфалерит ), одной из форм сульфида цинка (β-ZnS). Как и в структуре каменной соли, два типа атомов образуют две взаимопроникающие гранецентрированные кубические решетки. Однако он отличается от структуры каменной соли тем, как две решетки расположены относительно друг друга. Структура цинковой обманки имеет тетраэдрическую координацию : ближайшие соседи каждого атома состоят из четырех атомов противоположного типа, расположенных как четыре вершины . В целом расположение атомов в структуре цинковой обманки такое же, как в кубической структуре алмаза, но с чередующимися типами атомов в разных узлах решетки.
Примеры соединений с такой структурой включают саму цинковую обманку, нитрат свинца (II), многие сложные полупроводники (такие как арсенид галлия и теллурид кадмия ) и множество других бинарных соединений.
Другими соединениями, демонстрирующими структуру, подобную цинковой обманке, являются α-AgI, β-BN, алмаз, CuBr, β-CdS, BP и BAs.
Именование неорганических соединений
ИЮПАК ввел полиэдрический символ (англ. Polyhedral symbol) в части «рекомендации номенклатуры по ИЮПАК в неорганической химии 2005» (англ. IUPAC nomenclature of inorganic chemistry 2005 recommendations) для описания геометрии вокруг атома в соединении.
IUCr (International Union of Crystallography) предложили символ, который показывается как верхний индекс в квадратных скобках в химической формуле. Например, CaF2 будет записан как CaF2, где означает что это кубическая координация и означает — четырехгранная. Эквивалентный символ в ИЮПАК обозначается как CU
−8 иT -4 соответственно.
Символ ИЮПАК применим к комплексам и молекулам, в то время как по предложению IUCr это относится к кристаллическим твердым телам.
Физические свойства металлов
Физические свойства определяются внутренним строением металлов.
И хотя ученые создали неметаллические материалы, обладающие другим строением, но такими же свойствами, как у металлов и сплавов, они еще слишком дороги для массового применения. Многие химически чистые металлы обладают недостаточной прочностью для практических применений, чтобы исправить ситуацию, в технике и строительстве используют их сплавы.  Добавление тех или иных присадок приводит к росту прочность получаемого вещества в десятки раз по отношению к исходному элементу.
Добавление тех или иных присадок приводит к росту прочность получаемого вещества в десятки раз по отношению к исходному элементу.
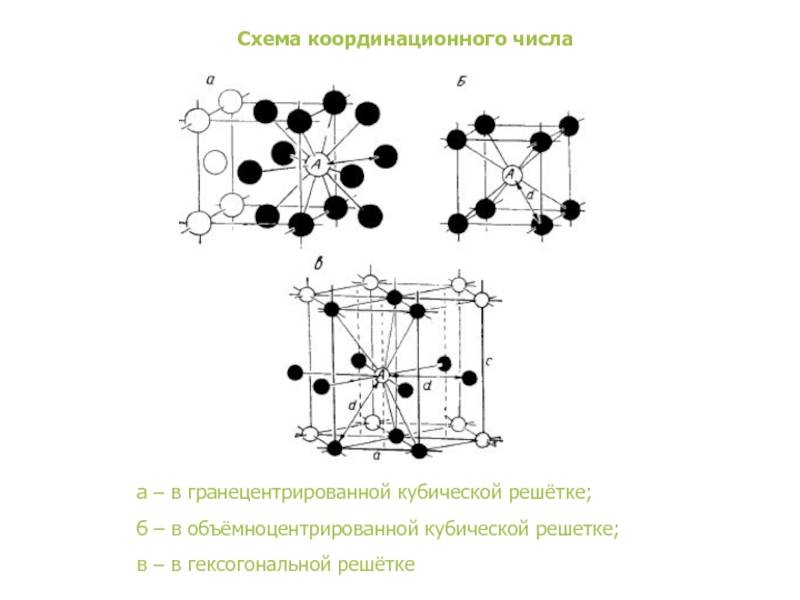
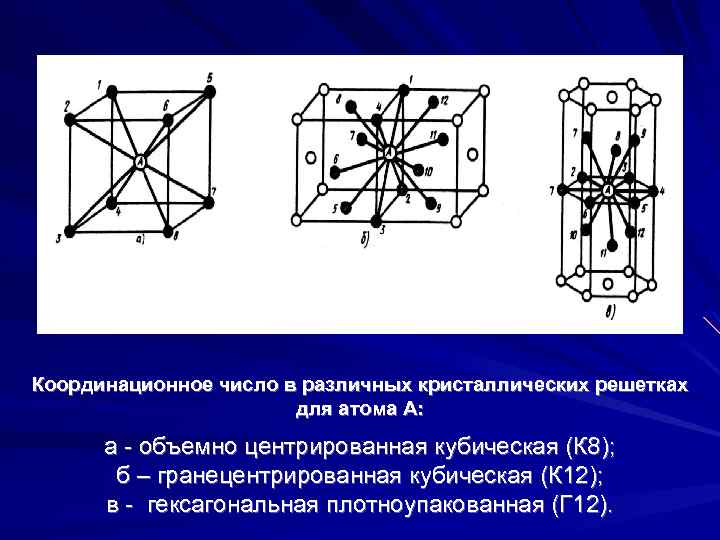
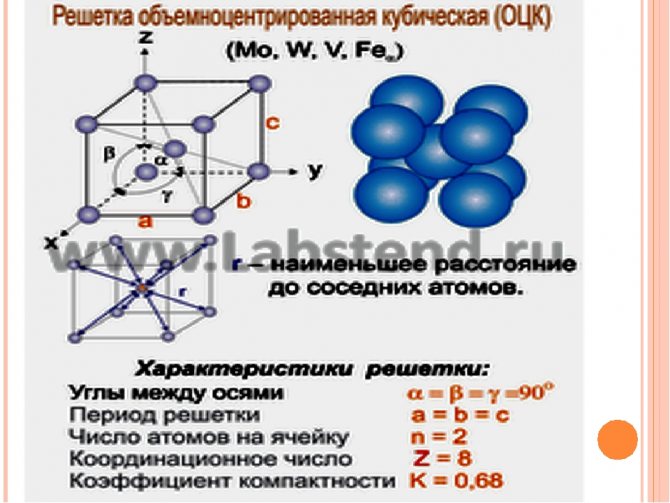
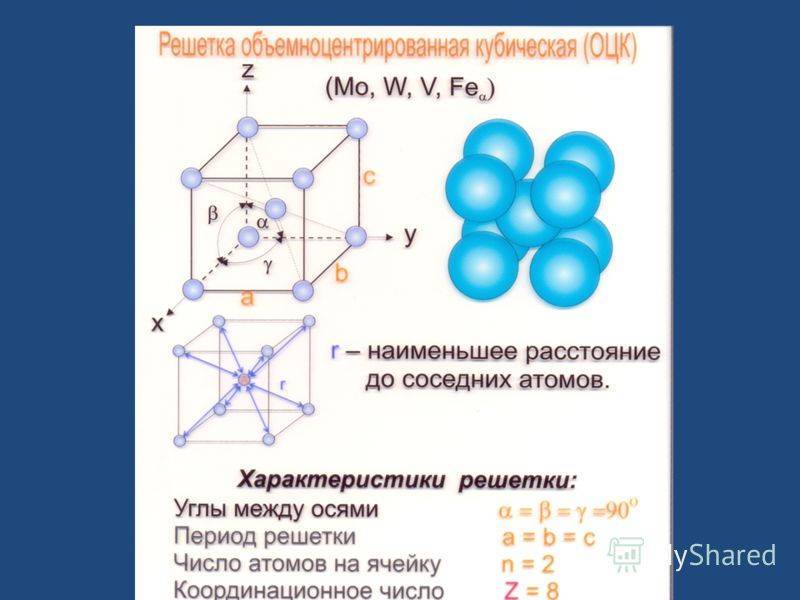
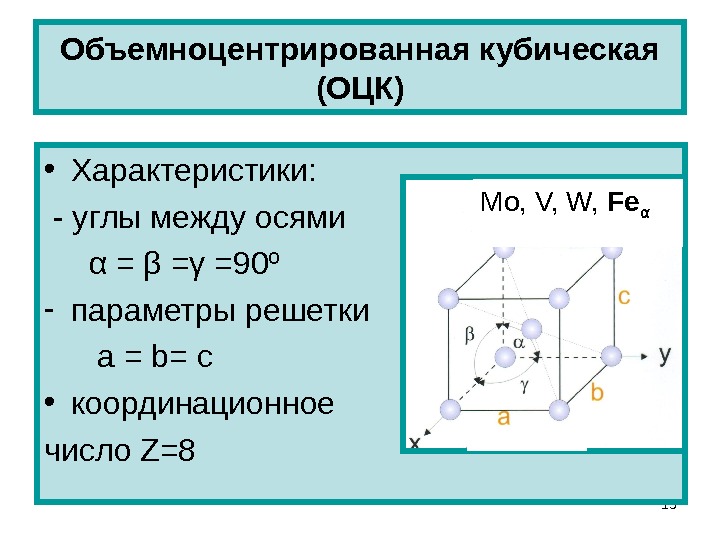
А) объемноцентрированная кубическая
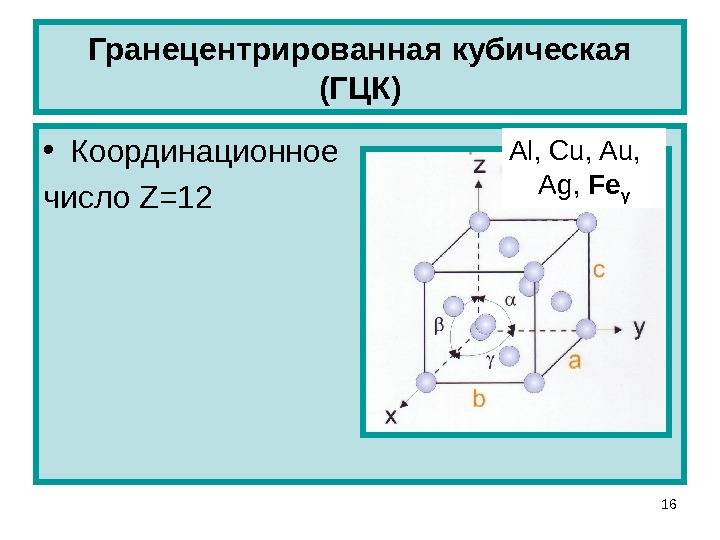
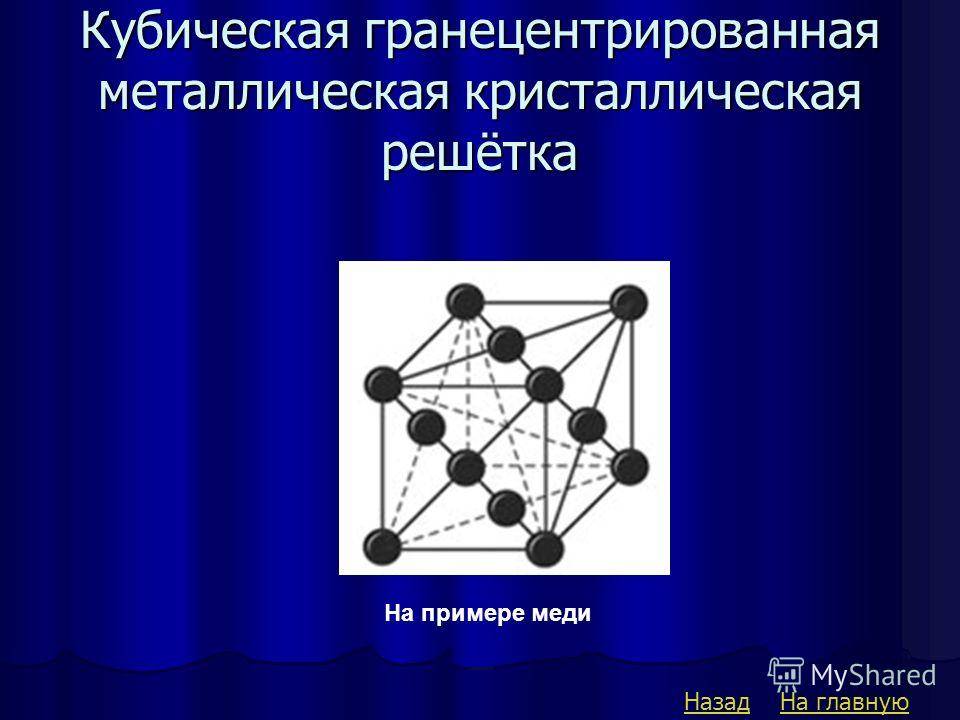
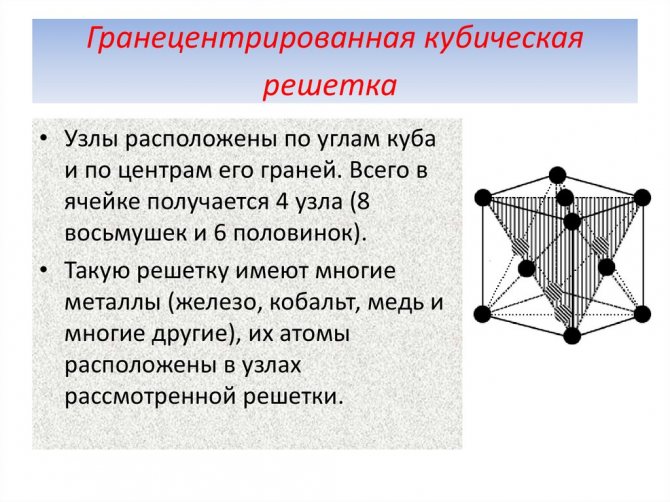
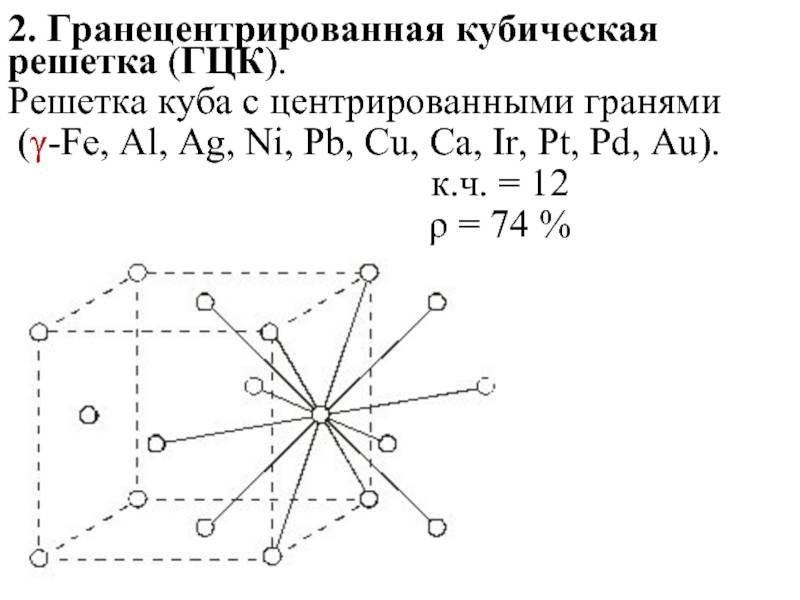
б) гранецентрированная кубическая
в) гексагональная плотноупакованная
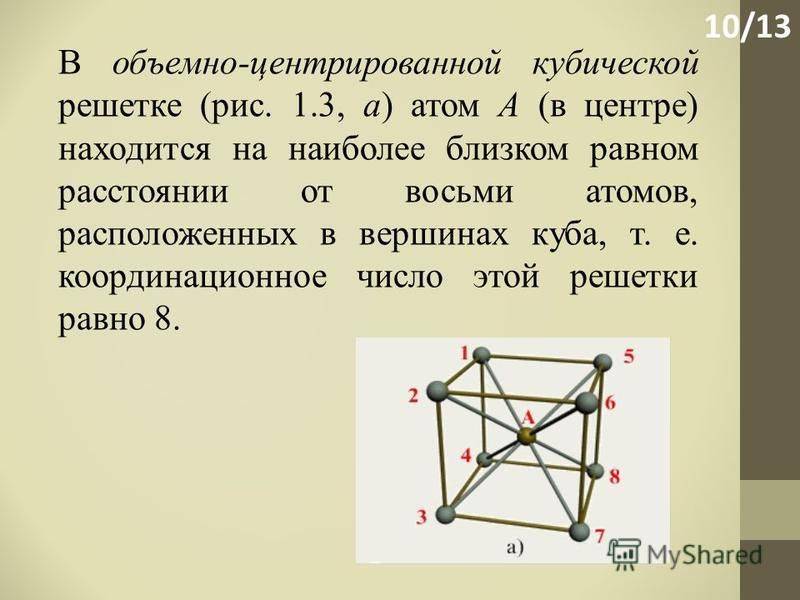
Некоторые металлы, в зависимости от температуры, могут иметь различный тип кристаллической решётки, т.е. могут существовать в различных кристаллических модификаций.
Полиморфизм (аллотропия) – когда металл имеет разную кристаллическую решётку в зависимости от условия образования. Переход одной решётки в другую называется полиморфное или аллотропическое состояние. Полиморфные превращения в металлах происходят при изменении температуры. Так, при температуре свыше 723°С железо переходит из α – модификации в γ – модификацию, при этом изменяются физико-механические свойства металла.
Чтобы отличить одну кристаллическую решётку железа Fe от другой ставят значок α или γ
В монокристаллах свойства металла по различным направлениям различны – это явление носит название анизотропией.
В реальных поликристаллических металлах свойства по любому направлению одинаково – это явление называется изотропией.
Металлы обладают целым рядом общих свойств:
Высокая электо- и теплопроводимость
Характерный металлический блеск
Положительный коэффициент электросопротивления
Способность к значительной пластической деформации
Одним из самых распространенных материалов, с которым всегда предпочитали работать люди, был металл. В каждую эпоху предпочтение отдавалось разным видам этих удивительных веществ. Так, IV-III тысячелетия до нашей эры считаются веком хальколита, или медным. Позже его сменяет бронзовый, а затем в силу вступает тот, что и по сей день является актуальным — железный.
Сегодня вообще сложно представить, что когда-то можно было обходиться без металлических изделий, ведь практически все, начиная от предметов быта, медицинских инструментов и заканчивая тяжелой и легкой техникой, состоит из этого материала или включает в свой состав отдельные части из него. Почему же металлы сумели завоевать такую популярность? В чем проявляются особенности и как это заложено в их строении, попробуем разобраться далее.
Межстраничные сайты
Промежуточные участки с гранецентрированной кубической сеткой
Гранецентрированная кубическая элементарная ячейка имеет два типа промежуточных узлов, где, если места достаточно, может быть размещен атом меньшего размера (как правило):
тетраэдрические узлы : расположены в тетраэдре, образованном угловым атомом и тремя центральными атомами граней, пересекающимися в этом же углу. Каждый угол связан с тетраэдрическим участком, каждый из которых является внутренним по отношению к сетке, образуя 8 тетраэдрических узлов .
октаэдрические участки : центрированная по граням кубическая элементарная сетка содержит октаэдрический участок в центре сетки, следовательно, внутренний по отношению к сетке (считается за 1). Он также включает сайт с центром в середине каждого края, разделяемый 4 сетками, то есть 12 x 1/4 = 3 собственных сайта . Таким образом, центрированная по граням кубическая элементарная ячейка содержит в общей сложности 4 октаэдрических узла на ячейку.
- Замечания
- Твердые вещества, такие как хлорид натрия (соль), имеют кристаллическую структуру, подобную cfc, где все октаэдрические межузельные участки заняты. Например, если мы считаем, что атомы хлора расположены на вершинах решетки, тогда атомы натрия занимают все октаэдрические узлы решетки, и наоборот. Все октаэдрические узлы (4) заняты, что также соответствует количеству узлов на сетку, что позволяет соблюдать стехиометрию . Эту структуру также можно рассматривать как две вложенные сетки cfc , сдвинутые на вектор (1/2; 0; 0) .
- Структура типа « алмаз » представляет собой гранецентрированную структуру кубического типа, в которой 4 из 8 тетраэдрических узлов ( 2 внизу по одной диагонали и 2 вверху по другой диагонали) заняты атомами того же сорта, что и те. ., составляющие сетку. Структура типа « обманка » имеет тот же тип, с той разницей, что атомы, занимающие тетраэдрические позиции, имеют разную природу ( сера для цинковой сетки и наоборот, для сфалерита (ZnS), нынешнее название обманки ). Половина тетраэдрических позиций (4) занята, что также соответствует количеству атомов в ячейке, что позволяет соблюдать стехиометрию . Ромбовидную структуру также можно рассматривать как две вложенные сетки cfc, сдвинутые на вектор (1/4; 1/4; 1/4) .
- Гидриды металлов, используемые для хранения водорода, используют тетраэдрические участки; как правило, используется металл структуры cfc, в который атомы водорода «вставлены» (они поглощаются), которые, следовательно, занимают тетраэдрические позиции, такие как палладий .
Наличие порядка в расположении частиц
В аморфном веществе, в отличие от кристаллического, отсутствует какой-либо порядок в расположении частиц. Если же в кристаллическом веществе мысленно соединить прямой два близкоросположенных друг к другу атома, то можно обнаружить, что на этой линии на строго определенных промежутках будут лежать одни и те же частицы:
Таким образом, в случае кристаллических веществах можно говорить о таком понятии, как кристаллическая решетка.
Кристаллической решеткой называют пространственный каркас, соединяющий точки пространства, в которых находятся частицы, образующие кристалл.
Точки пространства, в которых находятся образующие кристалл частицы, называют узлами кристаллической решетки.
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают: молекулярную, атомную, ионную и металлическую кристаллические решетки.
В узлах молекулярной кристаллической решетки Кристаллическая решетка льда Кристаллическая решетка льда как пример молекулярной решетки
находятся молекулы, внутри которых атомы связаны прочными ковалентными связями, однако сами молекулы удерживаются друг возле друга слабыми межмолекулярными силами. Вследствие таких слабых межмолекулярных взаимодействий кристаллы с молекулярной решеткой являются непрочными. Такие вещества от веществ с иными типами строения отличаются существенно более низкими температурами плавления и кипения, не проводят электрический ток, могут как растворяться, так и не растворяться в различных растворителях.
Растворы таких соединений могут как проводить, так и не проводить электрический ток в зависимости от класса соединения. К соединениям с молекулярной кристаллической решеткой относятся многие простые вещества — неметаллы (отвержденные H2, O2, Cl2, ромбическая сера S8, белый фосфор P4), а также многие сложные вещества – водородные соединения неметаллов, кислоты, оксиды неметаллов, большинство органических веществ. Следует отметить, что, если вещество находится в газообразном или жидком состоянии, говорить о молекулярной кристаллической решетке неуместно: корректнее использовать термин — молекулярный тип строения.
кристаллическая решетка алмаза Кристаллическая решетка алмаза как пример атомной решетки В узлах атомной кристаллической решетки
находятся атомы. При этом все узлы такой кристаллической решетки «сшиты» между собой посредством прочных ковалентных связей в единый кристалл. Фактически, такой кристалл является одной гигантской молекулой. Вследствие особенностей строения все вещества с атомной кристаллической решеткой являются твердыми, обладают высокими температурами плавления, химически мало активны, не растворимы ни в воде, ни в органических растворителях, а их расплавы не проводят электрический ток. Следует запомнить, что к веществам с атомным типом строения из простых веществ относятся бор B, углерод C (алмаз и графит), кремний Si, из сложных веществ — диоксид кремния SiO2 (кварц), карбид кремния SiC, нитрид бора BN.
У веществ с ионной кристаллической решеткой в узлах решетки находятся ионы, связанные друг с другом посредством ионных связей.
Поскольку ионные связи достаточно прочны, вещества с ионной решеткой обладают сравнительно высокой твердостью и тугоплавкостью. Чаще всего они растворимы в воде, а их растворы, как и расплавы проводят электрический ток. К веществам с ионным типом кристаллической решетки относятся соли металлов и аммония (NH4+), основания, оксиды металлов. Верным признаком ионного строения вещества является наличие в его составе одновременно атомов типичного металла и неметалла.
Кристаллическая решетка хлорида натрия
Кристаллическая решетка хлорида натрия как пример ионной решетки Однако следует отметить, что в веществах с ионным типом строения нередко можно обнаружить, помимо ионных, также ковалентные полярные связи. Это наблюдается в случае сложных ионов, т.е. состоящих из двух или более химических элементов (SO42-, NH4+, PO43- и т.д.). Внутри таких сложных ионов атомы связаны друг с другом ковалентными связями.
Металлическая кристаллическая решетка
наблюдается в кристаллах свободных металлов, например, натрия Na, железа Fe, магния Mg и т.д. В случае металлической кристаллической решетки, в ее узлах находятся катионы и атомы металлов, между которыми движутся электроны. При этом движущиеся электроны периодически присоединяются к катионам, таким образом нейтрализуя их заряд, а отдельные нейтральные атомы металлов взамен «отпускают» часть своих электронов, превращаясь, в свою очередь, в катионы. Фактически, «свободные» электроны принадлежат не отдельным атомам, а всему кристаллу.
Произвольный набор атомов
Тень обратной решетки интенсивности граненого углеродного пентакона, состоящего из 118 атомов, загорается красным при дифракции при пересечении сферы Эвальда.
Один путь к обратной решетке произвольного набора атомов происходит от идеи рассеянных волн в пределах Фраунгофера (дальнего расстояния или задней фокальной плоскости линзы) как суммы амплитуд в стиле Гюйгенса от всех точек рассеяния (в этот случай от каждого отдельного атома). Эта сумма обозначается комплексной амплитудой F в приведенном ниже уравнении, потому что это также преобразование Фурье (как функция пространственной частоты или обратного расстояния) эффективного потенциала рассеяния в прямом пространстве:
- Fг→знак равно∑jзнак равно1Nжjг→е2πяг→⋅р→j.{\ Displaystyle F = \ sum _ {j = 1} ^ {N} f_ {j} \ left e ^ {2 \ pi i {\ vec {g}} \ cdot {\ vec {r}} _ {j}}.}
Здесь g = q / (2π) – вектор рассеяния q в единицах кристаллографа, N – число атомов, f j – атомный коэффициент рассеяния для атома j и вектор рассеяния g , а r j – положение вектора атом j
Обратите внимание, что фаза Фурье зависит от выбора начала координат.. Для частного случая бесконечного периодического кристалла амплитуда рассеяния F = MF hkl от M элементарных ячеек (как и в случаях выше) оказывается ненулевой только для целых значений , где (часkл){\ displaystyle (hkl)}. Для частного случая бесконечного периодического кристалла амплитуда рассеяния F = MF hkl от M элементарных ячеек (как и в случаях выше) оказывается ненулевой только для целых значений , где (часkл){\ displaystyle (hkl)}
Для частного случая бесконечного периодического кристалла амплитуда рассеяния F = MF hkl от M элементарных ячеек (как и в случаях выше) оказывается ненулевой только для целых значений , где (часkл){\ displaystyle (hkl)}
Для частного случая бесконечного периодического кристалла амплитуда рассеяния F = MF hkl от M элементарных ячеек (как и в случаях выше) оказывается ненулевой только для целых значений , где (часkл){\ displaystyle (hkl)}
- Fчасkлзнак равно∑jзнак равно1мжjгчасkле2πя(частыj+kvj+лшj){\ displaystyle F_ {hkl} = \ sum _ {j = 1} ^ {m} f_ {j} \ left e ^ {2 \ pi i \ left (hu_ {j} + kv_ {j} + lw_ {j} \ right)}}
когда j = 1, m атомов внутри элементарной ячейки, дробные индексы решетки которых равны соответственно {u j , v j , w j }. Конечно, чтобы учесть эффекты, связанные с конечным размером кристалла, вместо этого следует использовать свертку формы для каждой точки или приведенное выше уравнение для конечной решетки.
Независимо от того, является ли массив атомов конечным или бесконечным, можно также представить себе “обратную решетку интенсивности” I [ g ], которая связана с решеткой амплитуд F через обычное соотношение I = F * F, где F * – комплексное сопряжение F Поскольку преобразование Фурье обратимо, конечно, этот акт преобразования в интенсивность отбрасывает «всю информацию, кроме 2-го момента» (то есть фазы). Таким образом, для случая произвольного набора атомов обратная решетка интенсивности имеет вид:
- яг→знак равно∑jзнак равно1N∑kзнак равно1Nжjг→жkг→е2πяг→⋅р→jk.{\ displaystyle I = \ sum _ {j = 1} ^ {N} \ sum _ {k = 1} ^ {N} f_ {j} \ left f_ {k} \ left e ^ {2 \ pi i {\ vec {g}} \ cdot {\ vec {r}} _ {jk}} .}
Здесь r jk – векторное расстояние между атомом j и атомом k. Это также можно использовать для прогнозирования влияния формы нанокристаллита и тонких изменений ориентации луча на обнаруженные дифракционные пики, даже если в некоторых направлениях толщина кластера составляет всего один атом. С другой стороны, расчеты рассеяния с использованием обратной решетки в основном учитывают падающую плоскую волну. Таким образом, после первого взгляда на эффекты обратной решетки (кинематического рассеяния), уширение луча и эффекты многократного рассеяния (т.е. динамические ) также могут быть важны для рассмотрения.
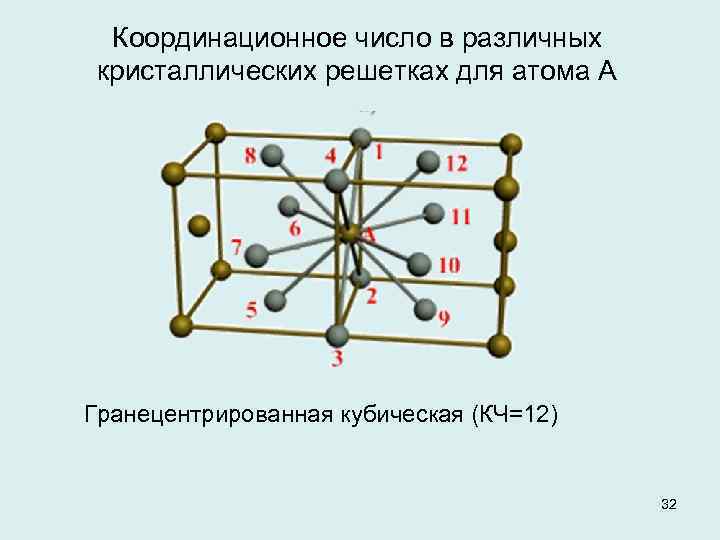
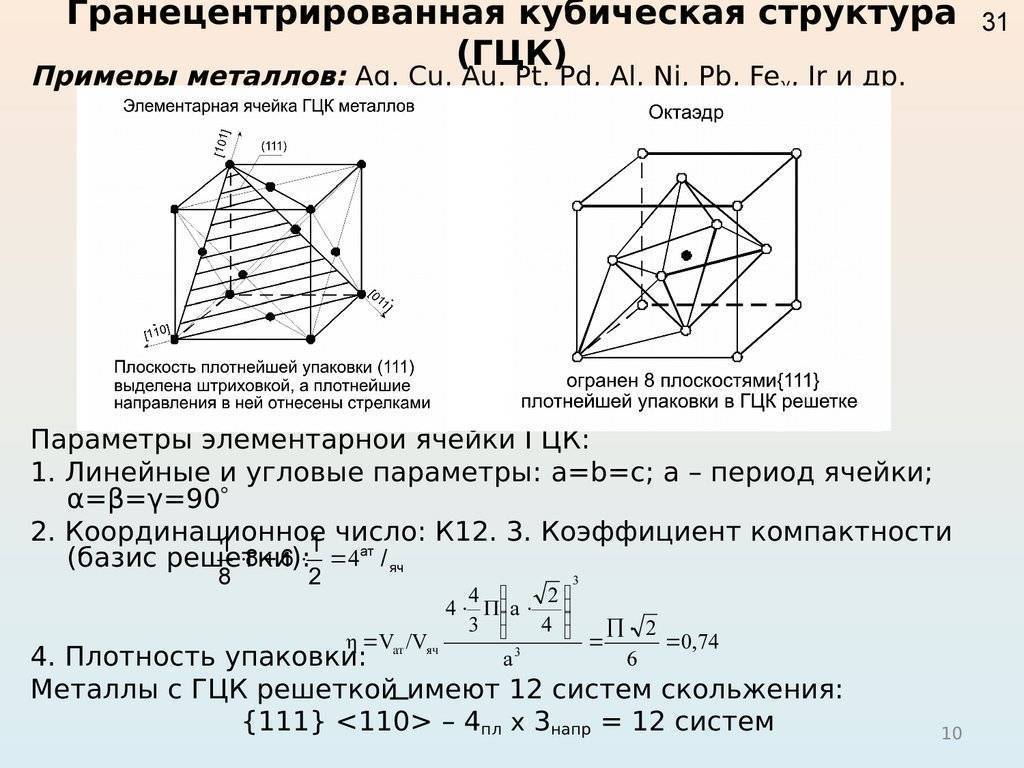
Кубическая гранецентрированная решетка
Алюминий является трехвалентным растворителем и имеет кубическую гранецентрированную решетку. Первая зона Брил-люэна у алюминия может вместить только два электрона на атом, и поэтому она должна перекрываться поверхностью Ферми. Однако, как показал Харрисон , степень перекрытия может быть различной, если исходить из сферической формы поверхности Ферми, характерной для свободных электронов. Наличие такого перекрытия у чистого алюминия, очевидно, весьма незначительно отражается на периоде решетки при образовании сплавов.
Медь и золото, кристаллизующиеся в кубической гранецентрированной решетке, образуют между собой при повышенных температурах и закалке непрерывный ряд твердых растворов.
Медь и золото, кристаллизующиеся в кубической гранецентрированной решетке, образуют между собой при повышенных температурах и закалке непрерывный ряд твердых растворов. При отжиге происходит процесс упорядочения в распределении атомов золота и меди в кристаллической структуре, причем степень упорядочения будет наибольшей для атомных соотношений Си: Аи 3: 1 и Си: Аи 1: 1, отвечающих соединениям Cu3Au и CuAu. Поскольку каждый атом в вершине куба принадлежит одновременно восьми соседним ячейкам, на данную ячейку приходится / 8 атома ill.
Рассмотрим увеличение концентрации свободных электронов в кубической гранецентрированной решетке ограниченного а-твердого раствора при добавлении элемента с более высоким номером группы периодической системы по сравнению с растворителем.
| Гексагональная плотнейшая упаковка. Пример. Mg ( a 3 22. с 5 23 А. |
Стронций, подобно кальцию, кристаллизуется в кубической гранецентрированной решетке, а 6 05 А.
Стронций, подобно кальцию, кристаллизуется в кубической гранецентрированной решетке, а – 6 05 А.
Стронций, подобно кальцию, кристаллизуется в кубической гранецентрированной решетке, а – 6 05 А.
Ковкость уменьшается при переходе от кристаллов с кубической гранецентрированной решеткой к металлам с центрированной кубической и гексагональной решетками. Условия, определяющие образование или изменение кристаллической структуры, сильно влияют на ковкость металлов или сплавов. До определенной температуры ковкость растет за счет ослабления связи между кристалликами, а после достижения допустимой максимальной температуры ковкость уменьшается – металлы становятся хрупкими. Это связано с образованием окисных пленок между кристаллами.
Эта формула строго справедлива для кристаллов с кубической гранецентрированной решеткой, однако при применении ее для кристаллов с другими типами решеток погрешность незначительна. Следует учитывать, что такого типа расчеты применимы для монокристаллов. Обычно же имеют дело с поликристаллическими сростками.
В гальванических сплавах Си-Sn наряду с кубической гранецентрированной решеткой меди и тетрагональной решеткой олова обнаружены еще две промежуточные фазы. Рассмотрим более подробно несколько систем.
Структура фтористого кальция показана на рис. 10.4. Это кубическая гранецентрированная решетка.
СМ) 6 атомы железа расположены в узлах кубической гранецентрированной решетки. На рис. 22.5 атомы Fe ( II) представлены заштрихованными кружками, а атомы Fe ( III) – светлыми. На рис. а все атомы железа находятся в трехвалентном состоянии; на рис. б половина атомов – это Fe ( II), а другая половина – Fe ( III); атомы щелочных металлов обеспечивают электронейтралыюсть соединения. Они расположены в центрах чередующихся малых кубов; предполагается, что в гидратированпых соединениях молекулы воды также могут располагаться в пустотах основной сетки. Литий и цезий, представляющие собой соответственно очень малый и очень большой ионы, не дают соединений, имеющих такую структуру. На рис. в все атомы железа находятся в двухвалентном состоянии, и внутри каждого малого куба находится атом щелочного металла. Группы CN располагаются между атомами металла вдоль сплошных линий на рис. 22.5, так что каждый атом переходного металла находится в центре октаэдра из 6 атомов С или 6 атомов N. Таким образом, в целом комплекс состава M / M ( CN) 6 образует простую 6-связанную трехмерную сетку.
| Первая зона ник называется первой зоной Бриллюэна Бриллюэна, симметрич -, х.. |
На рис. 2.6 показана первая зона Бриллюэна для кубической гранецентрированной решетки.